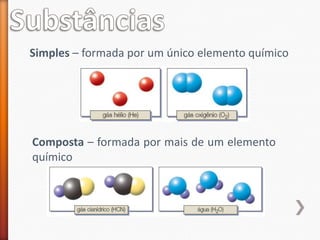
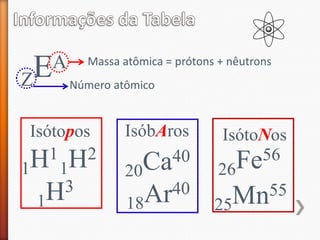
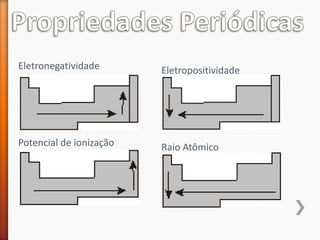
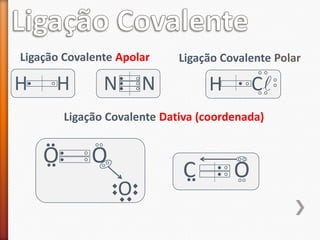
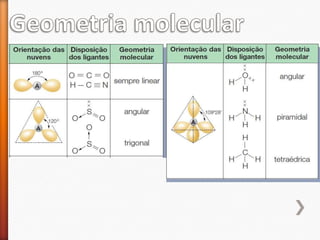
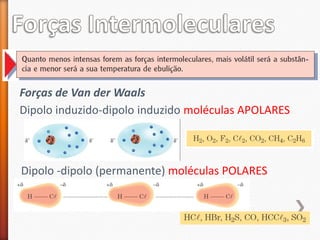
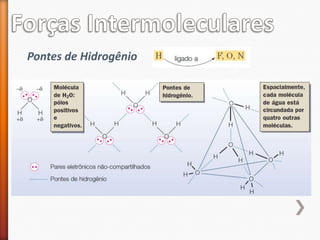
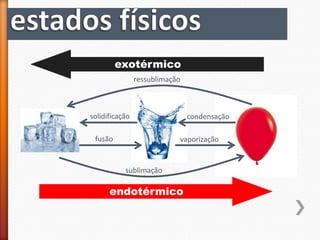
O documento aborda a evolução do modelo atômico desde Leucipo e Demócrito até os modelos mais modernos. Discute conceitos fundamentais da química, como classificação de elementos, tipos de ligações químicas, propriedades de compostos, isótopos, e reações químicas. Além de questões avaliação que contextualizam esses conceitos, também menciona as características do ouro e seus compostos.