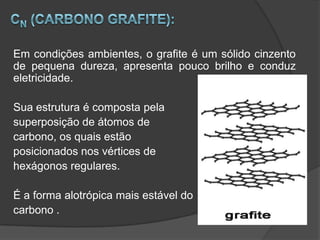
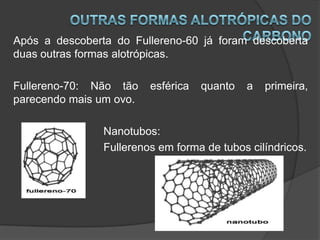
Alotropia é o fenômeno em que um mesmo elemento químico pode formar substâncias com estruturas ou propriedades diferentes, dependendo das condições. As formas alotrópicas de um elemento podem variar em atomicidade, estrutura molecular ou física. A forma mais estável é geralmente a mais abundante na natureza.