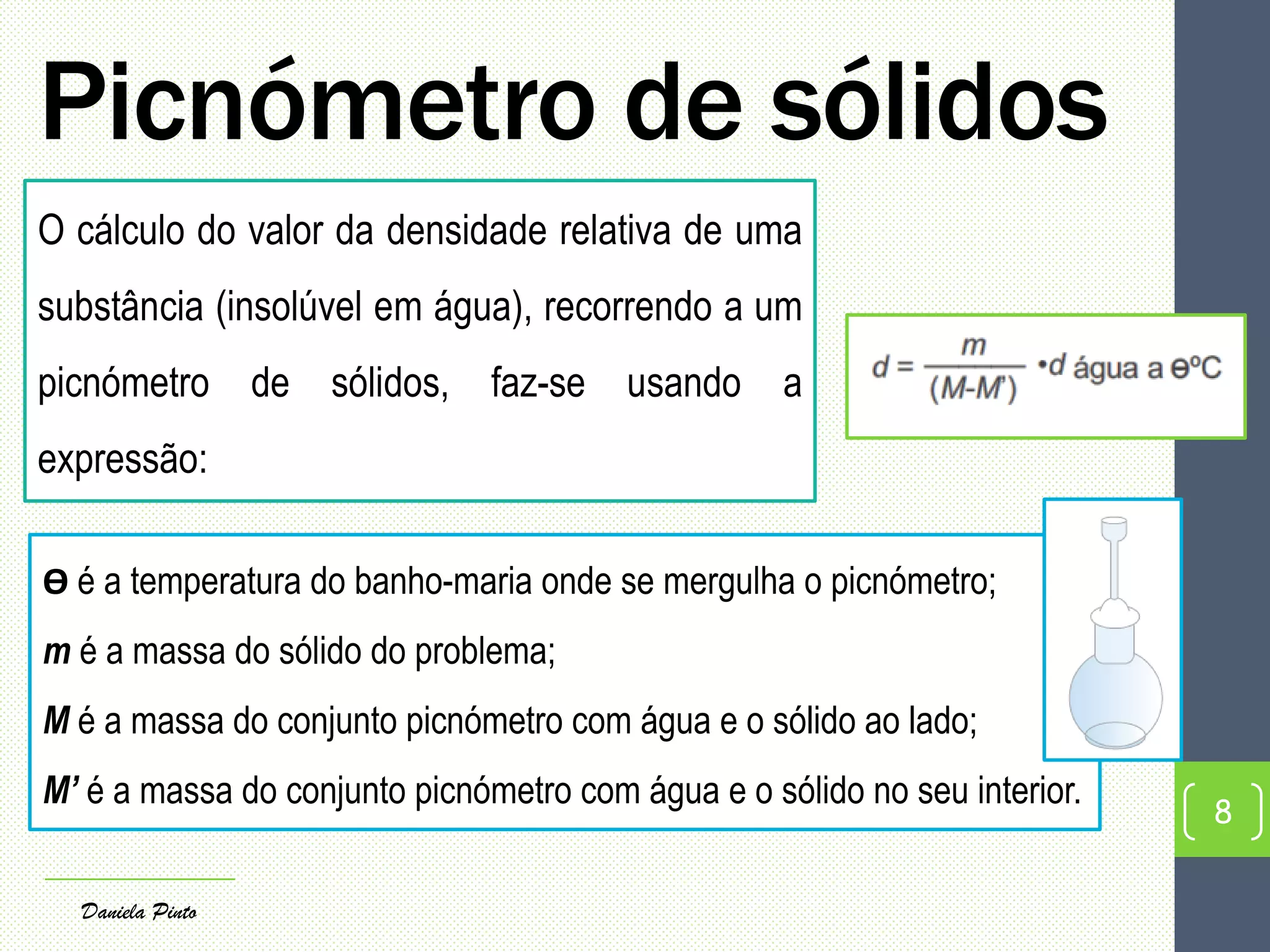
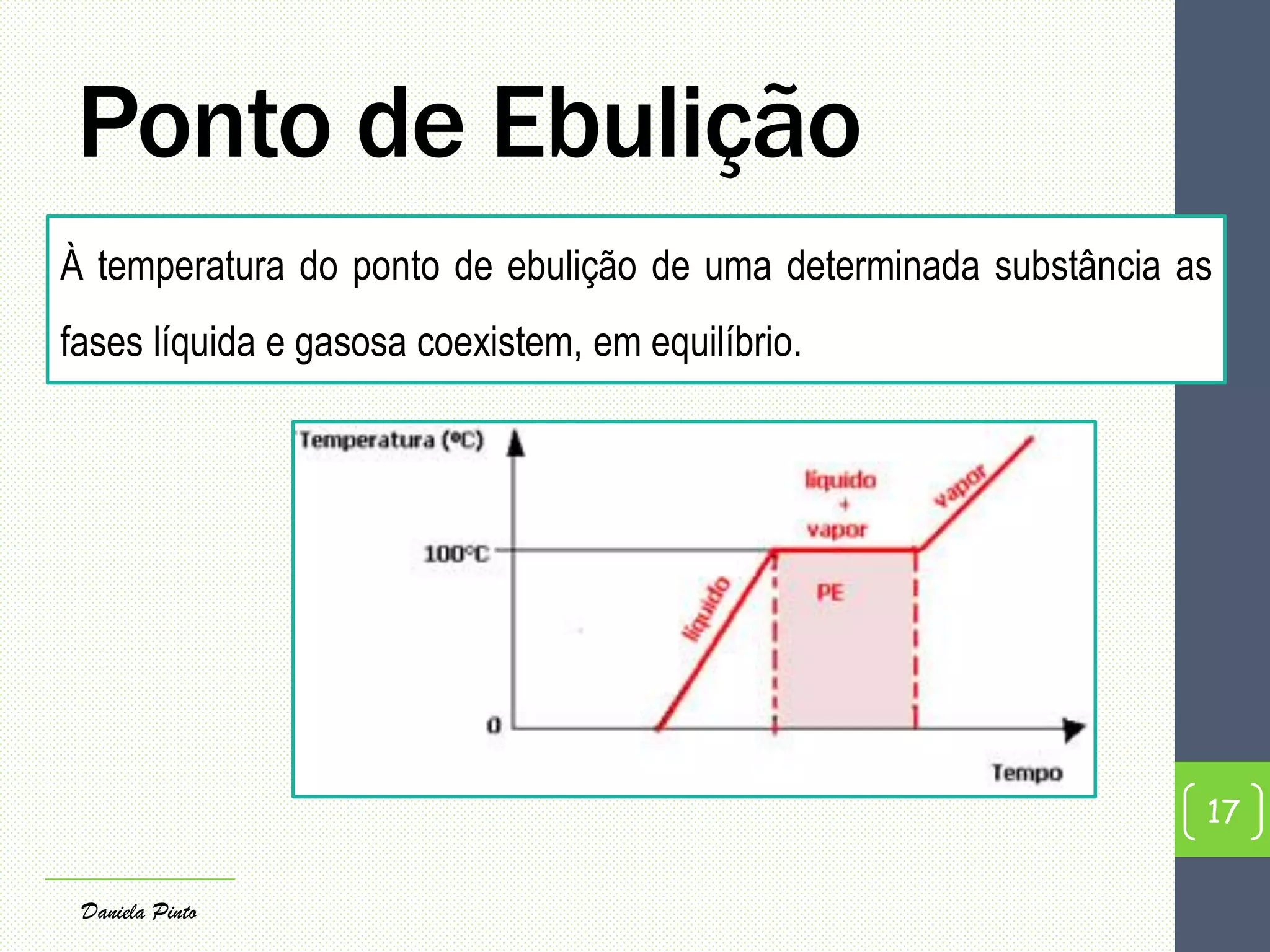
O documento discute as propriedades físicas que permitem identificar substâncias em laboratório, como densidade, ponto de fusão e ponto de ebulição. Explica os conceitos de mudanças de estado físico, como fusão, vaporização e métodos para medir densidade e pontos de fusão e ebulição.