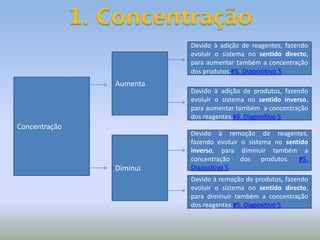
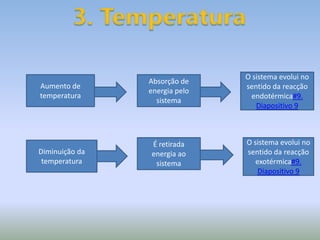
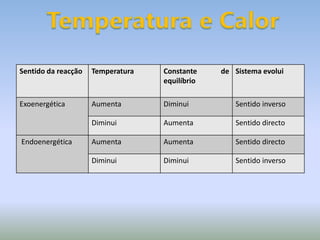
A Lei de LeChatelier estabelece que quando um sistema químico em equilíbrio é perturbado, ele evolui no sentido que contraria a perturbação para estabelecer um novo equilíbrio. As perturbações podem incluir mudanças na concentração, pressão ou temperatura. O documento explica como cada um desses fatores afeta o equilíbrio químico de acordo com a Lei de LeChatelier.