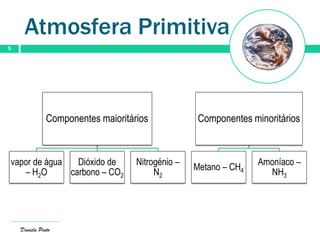
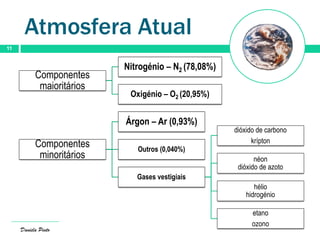
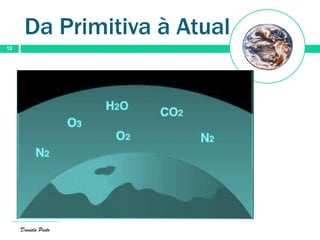
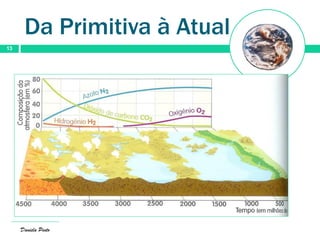
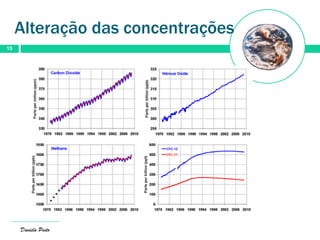
O documento descreve a evolução da atmosfera terrestre desde a sua formação primitiva até à atmosfera atual. Inicialmente composta por hidrogénio e hélio, a atmosfera primitiva foi constituída por vapores vulcânicos como vapor de água, dióxido de carbono e nitrogénio. Com o arrefecimento do planeta, a água condensou formando oceanos e a concentração de gases diminuiu. Posteriormente, a fotossíntese produziu oxigénio que se acumulou na at