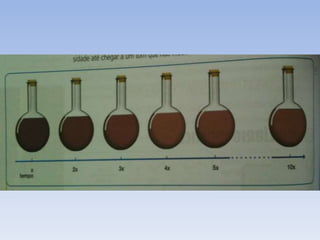
O documento discute equilíbrio químico, diferenciando processos reversíveis e irreversíveis. Explica que o equilíbrio químico é um estado de constante compensação onde as taxas de formação de reagentes e produtos são iguais. Aplica o princípio de Le Chatelier, onde qualquer perturbação no sistema leva o equilíbrio a se deslocar para minimizá-la.