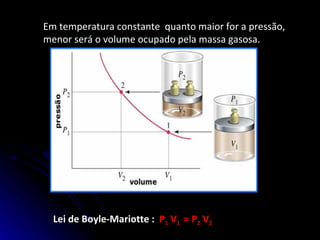
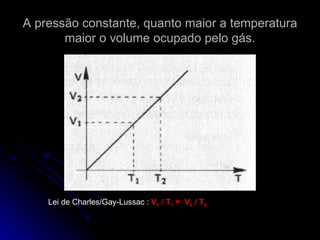
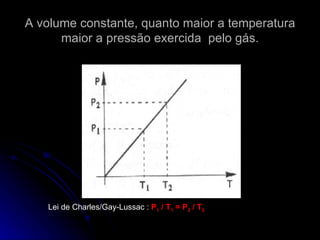
O documento resume as propriedades dos gases, incluindo sua compressibilidade e expansibilidade, a teoria cinética dos gases e as variáveis de estado. Também descreve as transformações isotérmicas, isobáricas e isovolumétricas dos gases e as leis de Boyle-Mariotte, Charles/Gay-Lussac e a equação de Clapeyron.