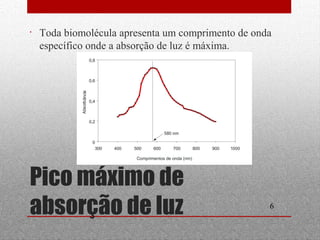
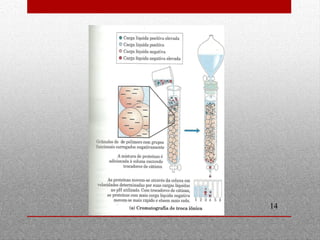
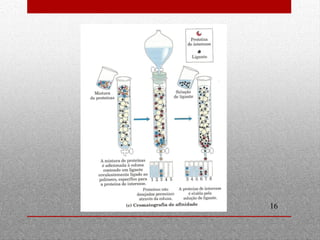
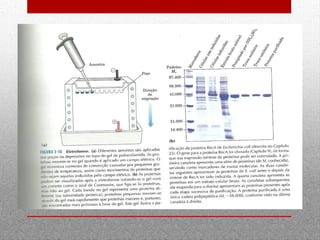
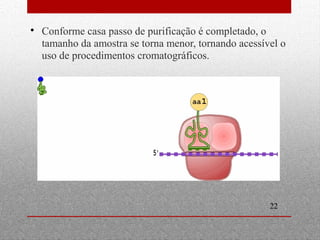
O documento discute espectrofotometria e métodos de purificação e caracterização de proteínas, incluindo a lei de Lambert-Beer, espectrometria de absorção atômica, diálise, cromatografia em coluna, cromatografia de troca iônica, cromatografia de afinidade, HPLC e eletroforese. Vários métodos geralmente precisam ser usados sequencialmente para purificar completamente uma proteína com base em diferentes propriedades.