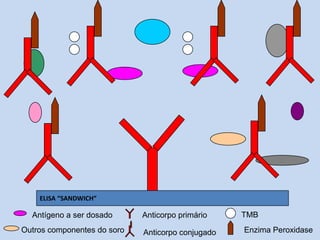
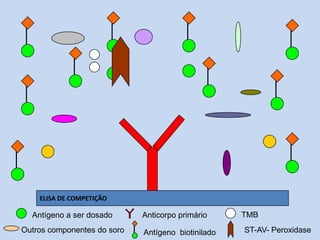
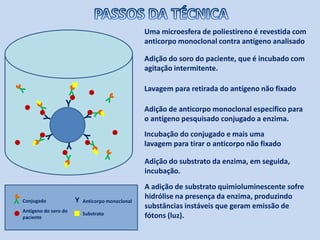
O documento discute dosagem de proteínas plasmáticas através de ensaios de imunodiagnóstico. Resume os principais tipos de proteínas plasmáticas, métodos de dosagem como ELISA e imunodifusão, e fatores que podem interferir nos resultados como escolha entre plasma e soro e hemólise.