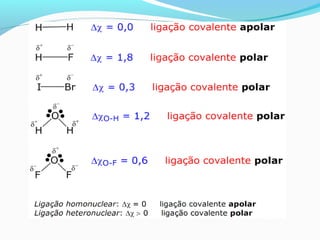
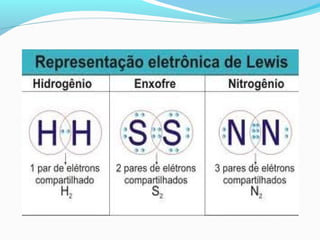
A ligação covalente é caracterizada pelo compartilhamento de elétrons entre átomos, causando atração mútua que mantém as moléculas unidas. Ela ocorre tipicamente entre não-metais e hidrogênio, como no caso da molécula H2 onde cada átomo de hidrogênio compartilha seu único elétron. Ligação covalente pode ser apolar, entre átomos iguais, ou polar, entre átomos diferentes como no caso da molécula H2O.