Incorporar apresentação
Baixado 21 vezes



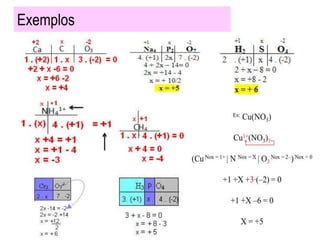
O documento explica o conceito de número de oxidação (NOX) e fornece regras para atribuir o NOX aos átomos em substâncias simples, íons e compostos. Define que o NOX representa a carga elétrica atribuída a cada átomo ou íon e fornece exemplos de NOX comuns para diferentes elementos químicos.



