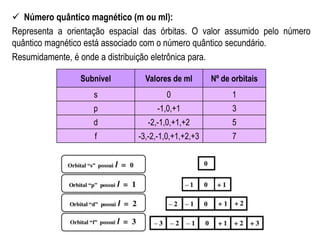
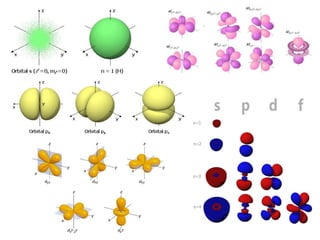
O documento explica os conceitos de números quânticos, que fornecem as coordenadas para localizar elétrons dentro de um átomo. São eles: nível de energia, subnível, orbital e spin. Também descreve as regras de preenchimento dos elétrons nessas coordenadas, como o Princípio da Exclusão de Pauli.