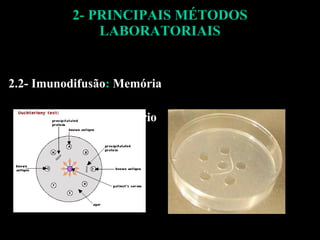
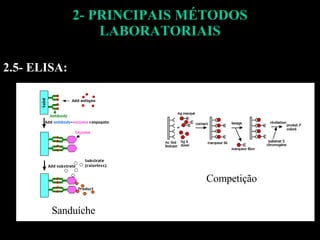
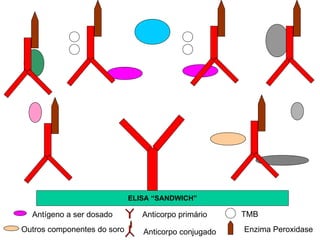
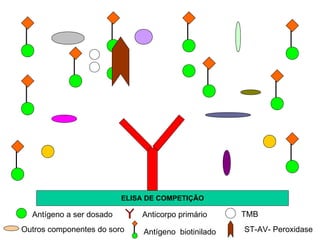
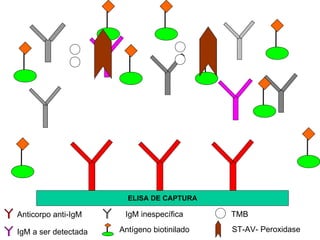
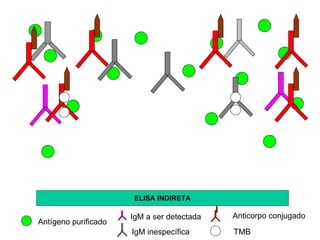
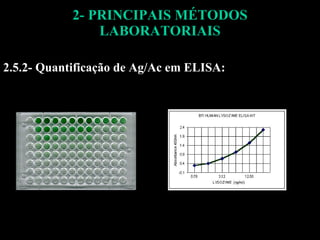
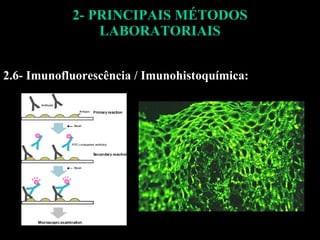
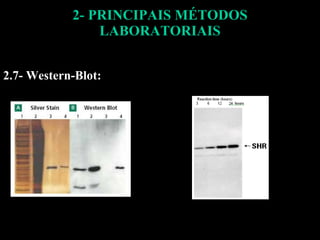
O documento descreve os principais métodos laboratoriais que utilizam anticorpos, incluindo suas características, vantagens e desvantagens. Aborda técnicas como imunoaglutinação, imunodifusão, hemoaglutinação, fixação de complemento, ELISA e imunofluorescência. O ELISA é destacado como o método mais sensível e específico atualmente.