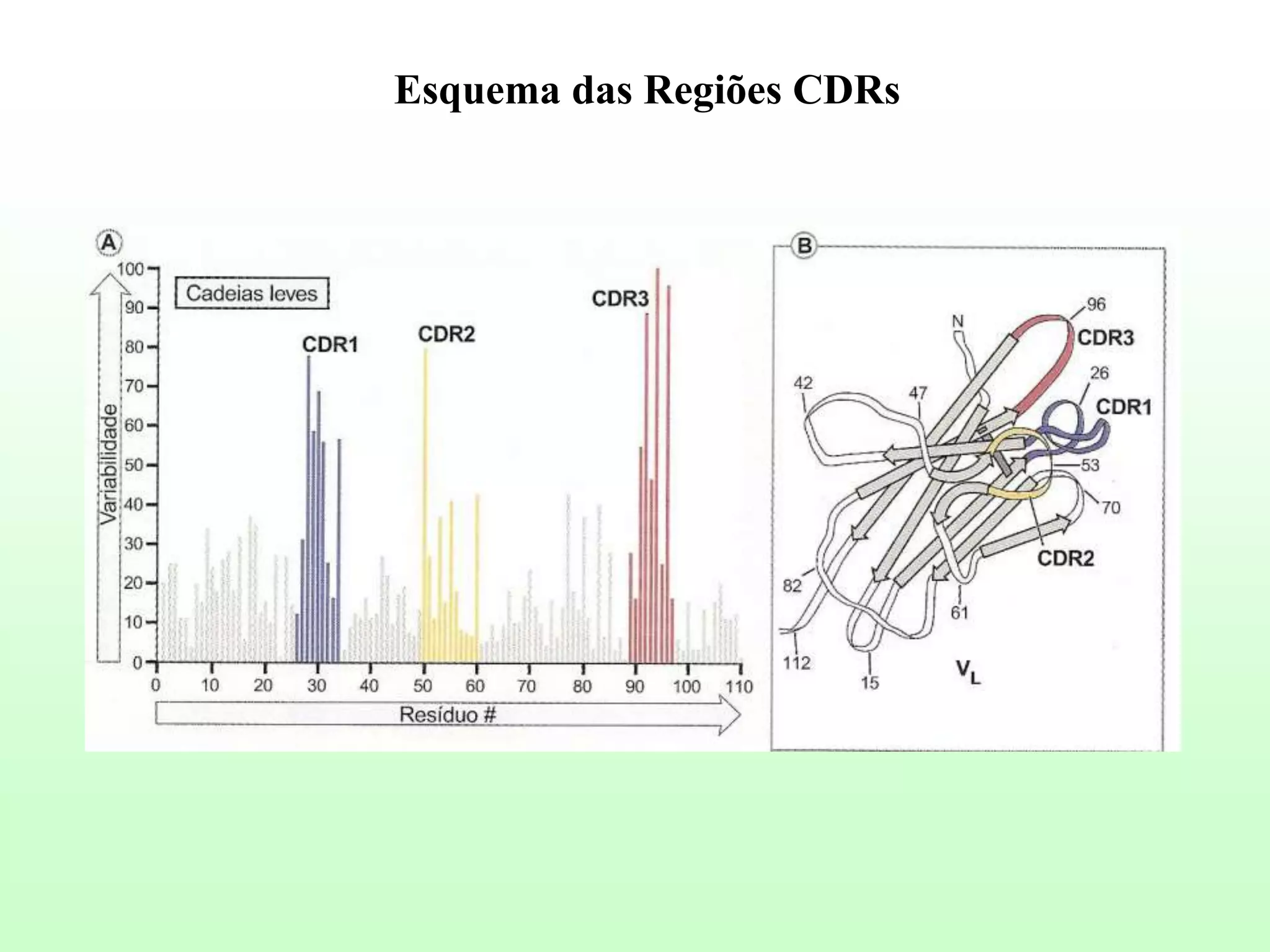
O documento descreve a estrutura e funções dos anticorpos, incluindo suas cadeias leves e pesadas, regiões Fab e Fc, ligação ao antígeno, e diferentes isotipos como IgG, IgA e IgM. Também discute conceitos como antígeno, determinantes antigênicos, afinidade, avidez e as forças de interação entre antígeno e anticorpo.