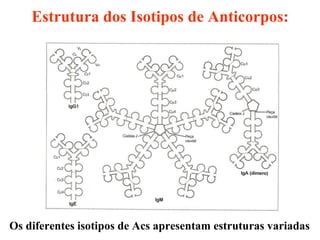
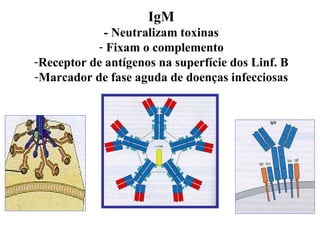
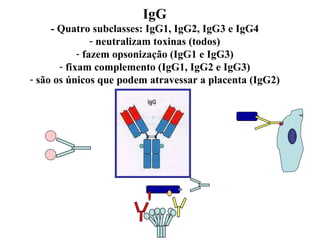
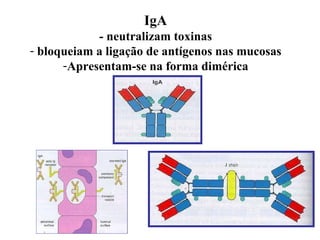
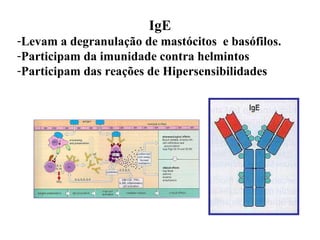
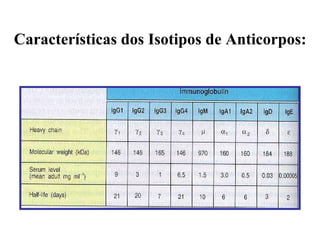
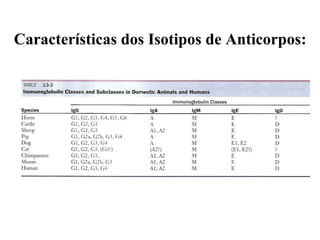
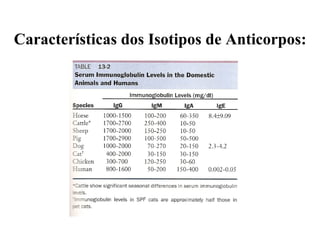
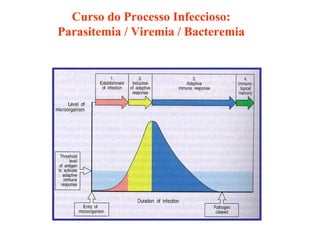
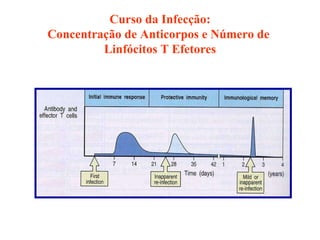
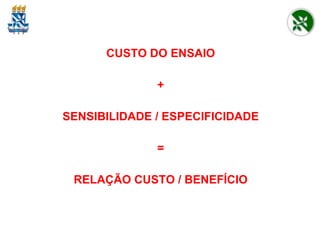
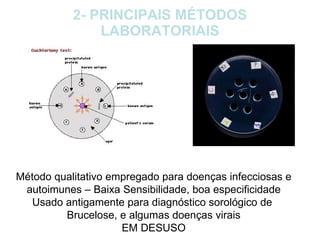
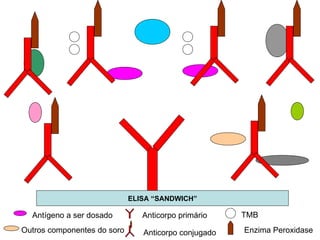
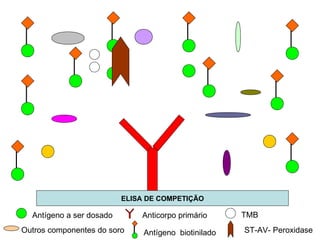
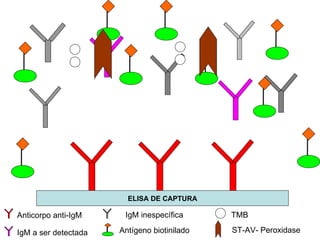
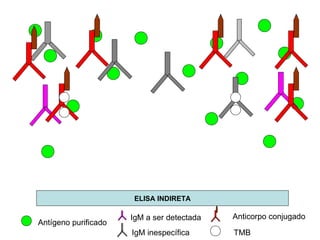
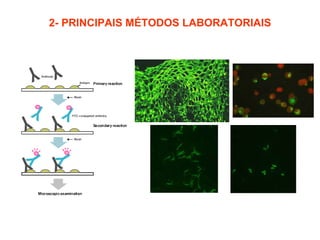
O documento discute critérios para escolha de testes de imunodiagnóstico, incluindo a importância da especificidade e sensibilidade. A especificidade evita falsos positivos enquanto a sensibilidade evita falsos negativos. O método deve ser adequado à amostra e ao antígeno-alvo, considerando custo e aplicabilidade. Testes confirmadores devem ter alta especificidade e testes de triagem alta sensibilidade.