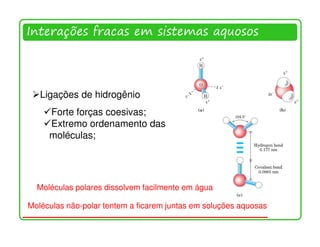
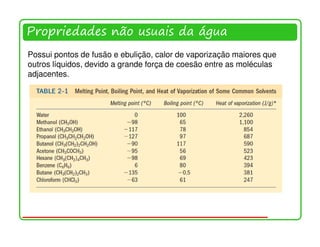
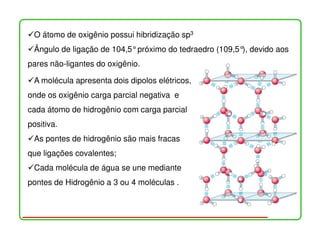
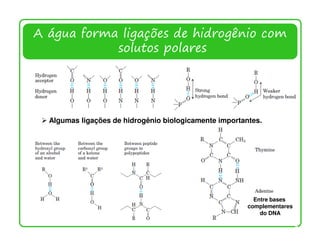
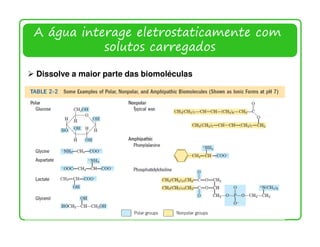
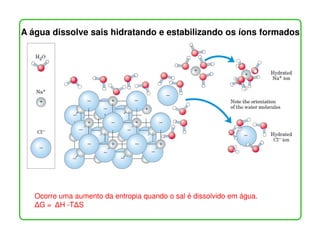
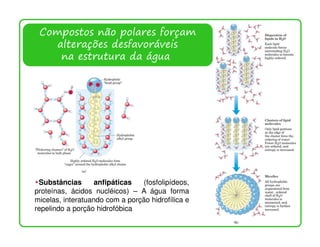
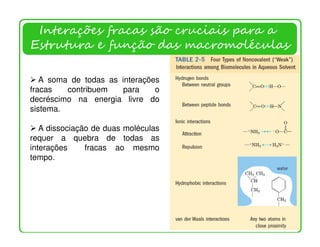
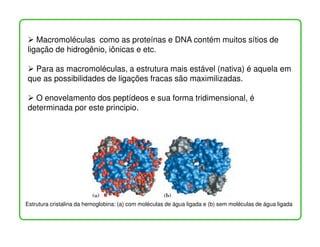
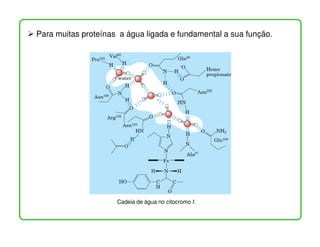
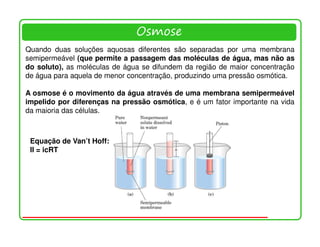
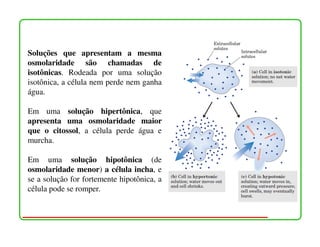
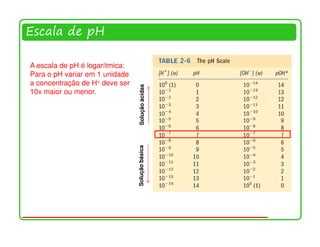
O documento descreve as propriedades e funções da água no corpo vivo. A água constitui a maior parte da massa dos seres vivos, permeia todas as células, e suas propriedades únicas como a capacidade de formação de ligações de hidrogênio permitem o transporte de nutrientes e reações metabólicas. A água também interage com moléculas polares e iônicas através de ligações de hidrogênio e forças eletrostáticas, o que é essencial para a estrutura e função de biomolécul




![Ionização da água, ácidos e bases fracos
H2O(l) + H2O(l) H3O+(aq) + OH-(aq)
Produto iônico da água:
[H3O + ][OH- ]
K eq =
[ H 2O]2
K eq × [H 2O]2 = [H3O+ ][OH- ]
K w = [ H3O+ ][OH- ] = 1.0 × 10−14
Assim, soluções ácidas: [H+] > 1,00 x 10-7 mol L-1
soluções básicas: [H+] < 1,00 x 10-7 mol L-1](https://image.slidesharecdn.com/gua2-120605161148-phpapp02/85/aGua-2-18-320.jpg)
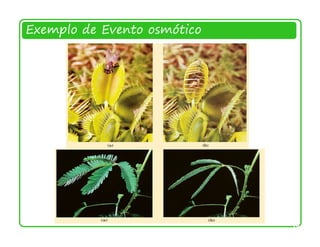
![Escala de pH
pH = − log[H3O+ ] = − log[H + ] pOH = − log[OH - ]
Em água neutra a 25 °C, pH = pOH = 7,00.
Em soluções ácidas, a [H+] > 1,0 × 10-7, então o pH < 7,00.
Em soluções básicas, a [H+] < 1,0 × 10-7, então o pH > 7,00
K w = [H + ][OH- ] = 1.0 × 10−14
( )
pK w = − log [ H + ][OH- ] = 14
∴ − log[H + ] − log[OH- ] = 14
pH + pOH = 14
• Todas as proteínas, inclusive enzimas, dependem do próton livre para a sua
atuação, para manter sua conformação molecular e permitir o encaixe do
substrato específico. Em realidade, uma enzima, seja qual for, requer uma
concentração de H+ que é ótima para sua atuação: é o pH ótimo (exemplos: o pH
ótimo da pepsina é 2, enquanto da amilase é 8).](https://image.slidesharecdn.com/gua2-120605161148-phpapp02/85/aGua-2-19-320.jpg)
![11. Equilíbrio de dissociação ácido-base
Constantes de Dissociação
O equilíbrio ácido-base mais comum ocorre em água.
HA + H2O H3O+ + A- H + A −
HA H + + A- Ka =
[HA]
Ácido forte: [HA] - muito pequeno – Ka muito grande
(dissociação completa)
Antes da dissociação Após dissociação
HA H+ A-
Constante de equilíbrio
para uma reação na qual
um ácido doa um próton
ao solvente.](https://image.slidesharecdn.com/gua2-120605161148-phpapp02/85/aGua-2-20-320.jpg)
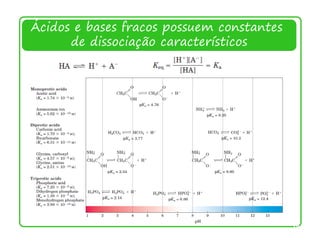
![11. Equilíbrio de dissociação ácido-base
• Constantes de Dissociação
Ácido fraco: [HA] é considerável. Ka pequeno (dissociação
incompleta) Antes da Após
dissociação dissociação
HA
HA
H+ A-
O mesmo pode ser realizado para uma base BOH dissociada
em água: BOH B+ + OH-
B + OH − Constante de equilíbrio para
Kb = uma reação na qual uma base
[BOH ] aceita um próton do solvente.](https://image.slidesharecdn.com/gua2-120605161148-phpapp02/85/aGua-2-21-320.jpg)

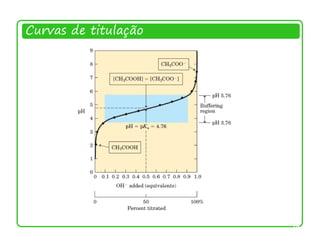
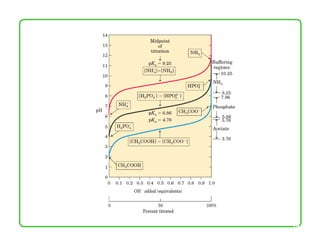
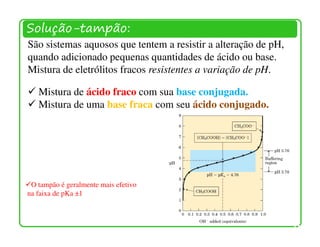
![Solução-tampão:
Capacidade do tampão
Equação de Henderson Hasselbalch:
− log[H + ] = − log K − log [HX ]
a -
[X ]
[X- ]
∴ pH = pK a + log
[HX]
O tampão é geralmente mais efetivo na faixa de pKa ±1](https://image.slidesharecdn.com/gua2-120605161148-phpapp02/85/aGua-2-29-320.jpg)
