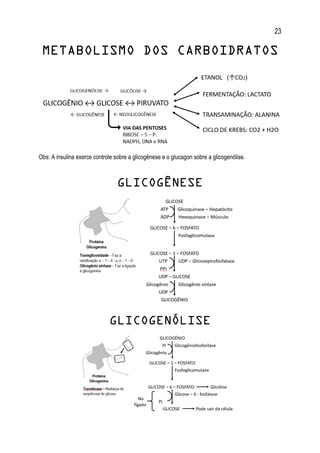
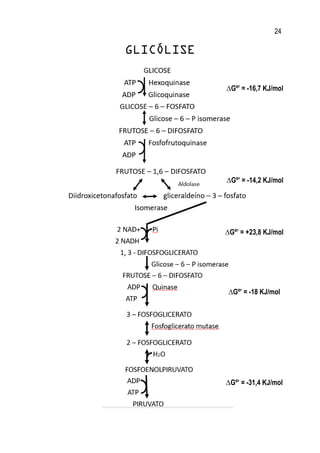
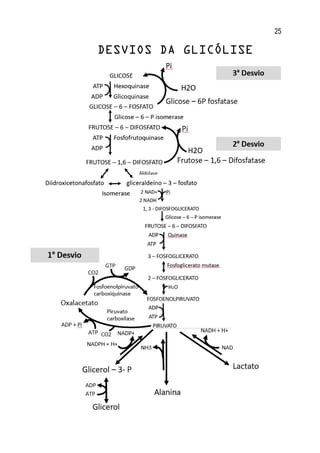
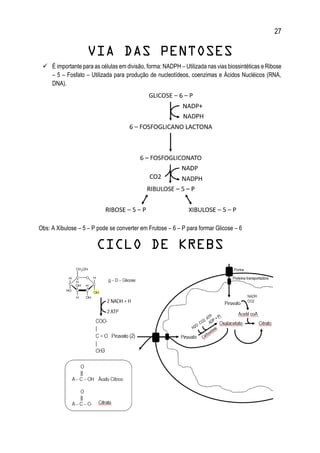
1. O documento apresenta um resumo sobre diversos conceitos fundamentais de bioquímica, incluindo água, soluções aquosas, tampões, aminoácidos, proteínas, enzimas, vitaminas, carboidratos, lipídeos e metabolismo.
2. Aborda tópicos como estrutura e propriedades da água, concentrações de soluções, tamponamento, estrutura e classificação de aminoácidos, níveis de organização e estabilização de proteínas, propriedades e cinética enzimática,



![2
Obs: Gelo – Estrutura em cristal: São formadas 4 pontes de hidrogênio por cada molécula.
H2O ↔ H+ + OH-
55,5 mols (1 L) ↔ 10-7 mols + 10-7 mols
M =
m
PM x V
=
1000g
18 x 1L
= 55,5 mols
Onde: M – Molaridade; m – Massa; PM – Peso Molecular; V – Volume
pH =
1
log [H+]
= - log [H+] → pH = -log10 [10-7] = 7
([OH-] [H+] = 10-14; [10-7 ] [10-7 ] = 10-14)](https://image.slidesharecdn.com/apostila-180715160526/85/Apostila-de-Bioquimica-4-320.jpg)

![4
do HCl possui grande afinidade pelo mesmo, e os dois se unem para formar o ácido acético, um
ácido fraco, por isso, o pH do meio não sofre grandes alterações. No entanto, se for adicionado
cada vez mais ácido forte, chegará o momento em que todo o ânion acetato será consumido e o
efeito do tampão cessará.
Adição de uma pequena quantidade de Base Forte (Ex – NaOH): A adição de uma base forte
aumenta as concentrações de íons OH-, que são neutralizados pelos íons H+, liberados na
ionização do ácido acético, formando água. Com essa reação, a concentração de H+ irá diminuir,
deslocando a reação no sentido de aumentar a ionização do ácido, e com isso, a variação do pH
será muito pequena. Nesse caso, também existe uma capacidade limite do tampão, portanto, se
adicionarmos cada vez mais base, o equilíbrio da ionização do ácido será mais e mais deslocado
no sentido da sua ionização, até que todo o ácido seja consumido.
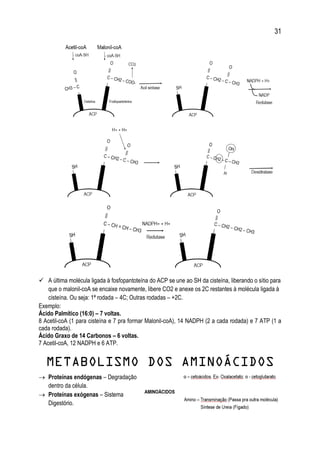
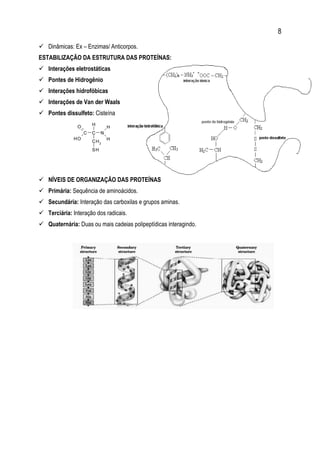
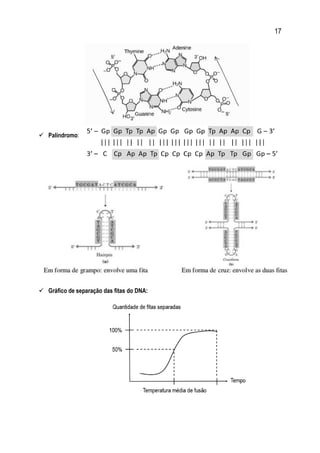
Curva de Titulação
Obs: Região sombreada – Região de Tamponamento
[4,26 – 5,26]
À medida que o NaOH é gradualmente introduzido, o íon OH adicionado combina-se com o H+
livre, formando água, em uma quantidade que satisfaz a relação de equilíbrio. À medida que o H+ é
removido, a molécula de ácido dissocia-se mais para satisfazer a sua própria constante de equilíbrio,
então, mais ácido ioniza-se, formando base conjugada, à medida que NaOH é adicionado. No ponto
médio, no qual 0,5 de NaOH foi adicionado, metade do Ácido Acético sofreu dissociação, de forma que
a concentração de ácido acético é igual a concentração de base conjugada.
Exemplos de Tampões
Substâncias PKa
Ácido Acético (CH3COOH) 4,76
Ácido Fosfórico (H3PO4) 2,1 - 7,2 - 12,3
Ácido Carbônico (H2CO3) 6,35 - 9,6
Glicina (NH3+CH2COOH) 2,3 - 9,6](https://image.slidesharecdn.com/apostila-180715160526/85/Apostila-de-Bioquimica-6-320.jpg)
![5
Equação de Henderson-Hasselbach: Interrelaciona pH, pKa e concentração do tampão.
A + B ↔ C + D AH ↔ A- + H+
Keq =
[C][D]
[A][B]
pH = pKa + log
[A-]
[AH]
pH = pKa
OBS:Trabalhar com as moléculas 2 e 3 em concentrações iguais para tamponar o sangue.
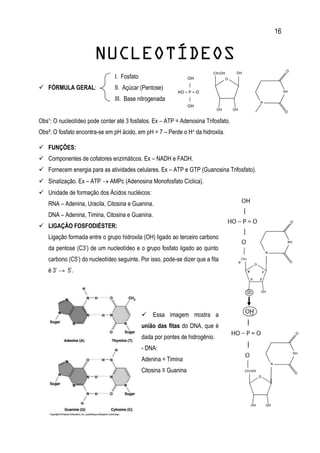
AMINOÁCIDOS
Blocos de construção das proteínas; 20 diferentes.
I. Grupo carboxila; II. Grupo amino; III. Grupo R; IV. Átomo de Hidrogênio.
Possuem isomeria espacial óptica: (Com exceção da glicina).
Carbono quiral ou assimétrico: Realiza quatro ligações diferentes.
O “D” e “L” significam Dextrógeno e Levógeno.
Se referem à posição do grupo amina.
F
licinaic
ina
I
I
I
II
V
Glicina
Aminoácido em](https://image.slidesharecdn.com/apostila-180715160526/85/Apostila-de-Bioquimica-7-320.jpg)

![10
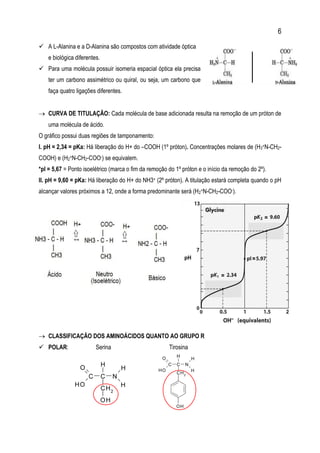
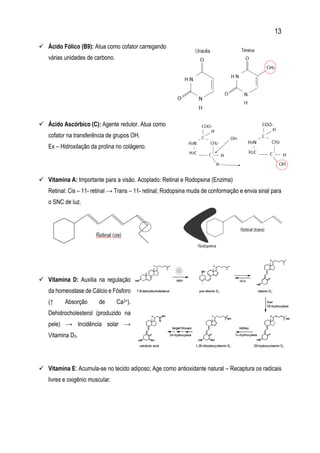
GRÁFICOS DE CINÉTICA
Obs: Algumas enzimas não funcionam assim.
Ex – Enzimas alostéricas (mais de uma subunidade).
I. Michaelis-Menten: Mostra que o aumento da concentração do
substrato, inicialmente aumenta a Vo, que cresce até atingir um valor
constante que sofre poucas alterações com a elevação da
concentração do substrato.
Km = Constante de Michaelis
II. Linewaber-Burke: Já que não é possível determinar a Vmáx a
partir do gráfico de Michaelis-Menten, utiliza-se o Gráfico dos
Duplos Recíprocos (ou gráfico de Lineweaver-Burk),
representação linear da equação de Michaelis-Menten.
Essa é uma equação de reta do tipo y = ax + b, onde: y = 1/ Vo;
a = Km/Vmáx; x = 1/ [S]; b = 1/ Vmáx
III. Efeito do pH: pH ótimo. IV. Efeito da temperatura
INIBIDORES:
I. Reversíveis:
Competitivo: (↑S ↓I) Concorre com o substrato
pelo sítio ativo da enzima, pois o inibidor é
semelhante ao substrato. A situação é resolvida
pela adição de mais substrato,
entretanto, o Km é aumentado.](https://image.slidesharecdn.com/apostila-180715160526/85/Apostila-de-Bioquimica-12-320.jpg)






![22
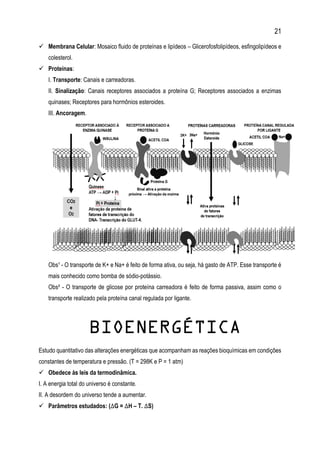
∆G = Variação da energia libre de Gibbs (J/mol) – Exergônica ou Endergônica.
∆H = (Entalpia) Variação da energia das ligações químicas (J/mol) – Exotérmica ou Endotérmica.
∆S = (Entropia) Grau de desordem (J/mol.K).
Hidrólise do ATP:
ATP + H2O → ADP + Pi
(∆Gº’ = -30,5 KJ/mol)
Obs¹: ∆Gº’ significa que a reação acontece em
condições bioquímicas padrão.
Obs²: A reação é exergônica.
Obs³: Ressonância do fosfato.
Quando a água “quebra” os fosfatos por hidrólise, ela promove o alívio da repulsão das cargas
negativas e o fosfato liberado se liga a outra molécula, energizando-a.
Após a reação, a água também tem a função de se interpor entre os produtos da reação, hidratando-
os e impedindo que a reação ocorra inversamente.
ATP + H2O → ADP + Pi (∆Gº’ = -30,5 KJ/mol)
Glicose + Pi → Glicose – 6 – P + H2O (∆Gº’ = +13,8KJ/mol)
Glicose + ATP → Glicose – 6 – P + ATP (∆Gº’ = -16,7KJ/mol)
∆Gº = ∆Gº’ + R . t . ln
[Produtos]
[Reagentes]
Glicose – 1 – P →Fosfoglicomutase→ Glicose – 6 – P
Obs¹: Quando a reação está em equilíbrio o ∆Gº é igual a zero.
0 = ∆Gº’ + 8,315 . 293 . ln
[1,9]
[0,1]
∆Gº’ = -7,3 KJ/mol
REAGENTES PRODUTOS
2 M 0 M
1 M 1 M
0,5 M 1, 5 M
0,1 M 1,9 M
cc](https://image.slidesharecdn.com/apostila-180715160526/85/Apostila-de-Bioquimica-24-320.jpg)