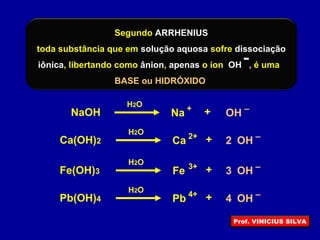
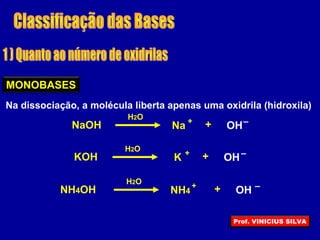
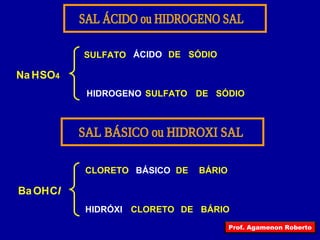
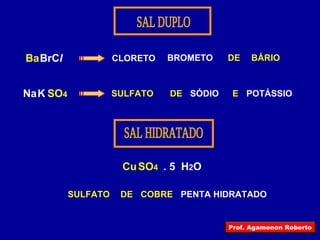
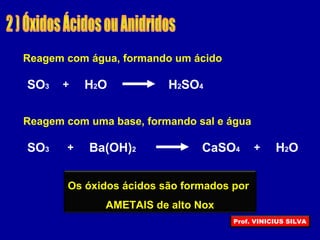
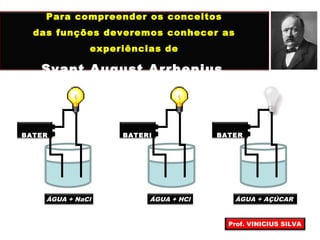
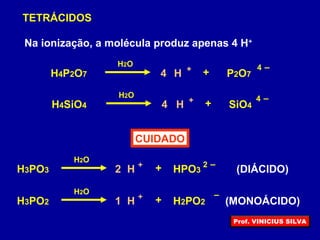
O documento descreve as principais propriedades das substâncias químicas e como elas podem ser agrupadas em funções inorgânicas de acordo com suas propriedades comuns. As principais funções inorgânicas descritas são ácidos, bases ou hidróxidos e sais. O documento também explica os conceitos de ácidos e bases segundo as experiências de Svante Arrhenius e como medir o grau de ionização de substâncias químicas.











![HIDRÁCIDOS
OXIÁCIDOS
HCl HCN H2S H4[Fe(CN)6]
São ácidos que não possuem o elemento químico OXIGÊNIO
HNO3 H2CO3 H2SO4 H3PO4
São ácidos que possuem o elemento químico OXIGÊNIO
Prof. VINICIUS SILVA](https://image.slidesharecdn.com/funcaoinorganica2-150722214028-lva1-app6891/85/FUNCOES-INORGANICAS-18-320.jpg)
![HCl
H4[Fe(CN)6]
H2CO3 HCN H2SO4
H2S
Possuem apenas dois elementos químicos
BINÁRIOS
Possuem apenas três elementos químicos
TERNÁRIOS
Possuem apenas quatro elementos químicos
QUATERNÁRIOS
Prof. VINICIUS SILVA](https://image.slidesharecdn.com/funcaoinorganica2-150722214028-lva1-app6891/85/FUNCOES-INORGANICAS-19-320.jpg)