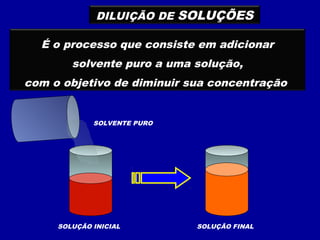
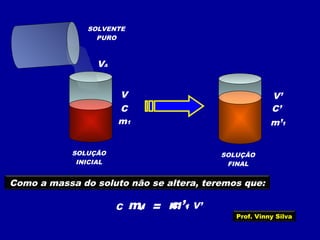
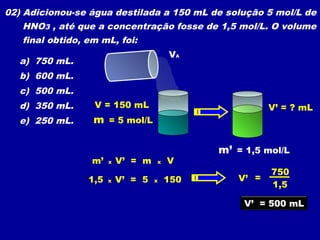
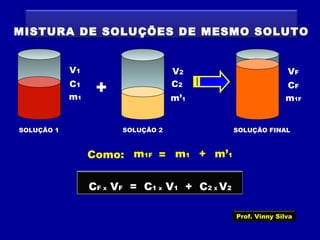
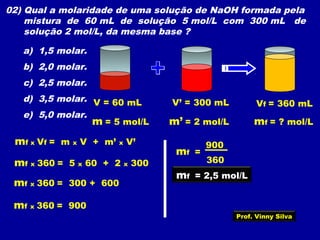
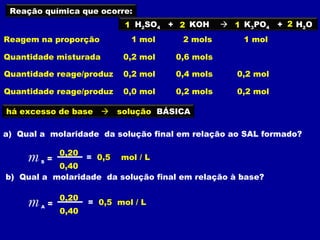
O documento apresenta conceitos fundamentais sobre soluções químicas, incluindo:
1) A definição de solução como uma dispersão onde o disperso possui tamanho médio de até 10-7 cm;
2) Os componentes básicos de uma solução - solvente e soluto;
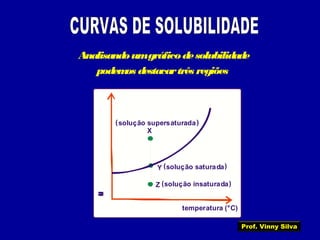
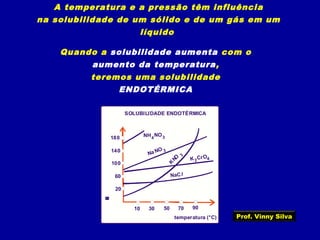
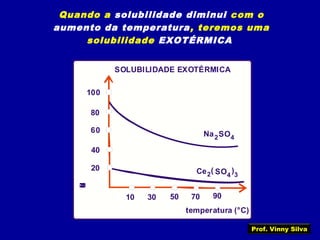
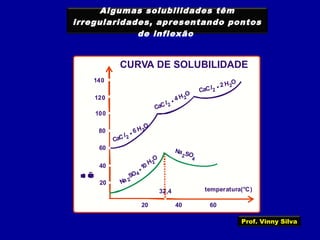
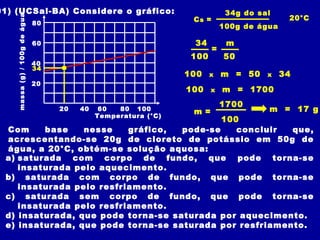
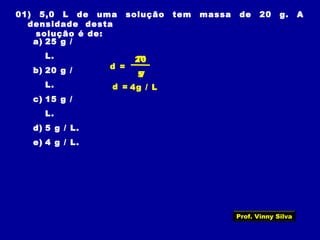
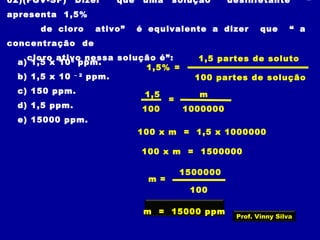
3) Conceitos como solubilidade, coeficiente de solubilidade, soluções saturadas, insaturadas e supersaturadas.