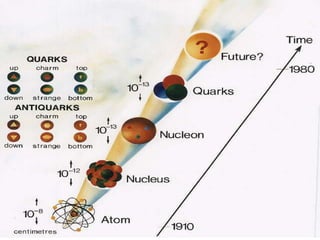
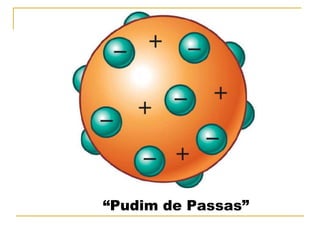
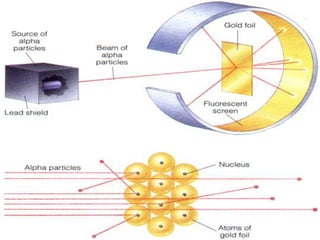
O documento descreve a evolução histórica da compreensão da estrutura atômica, desde os modelos filosóficos de Leucipo e Demócrito no século V a.C. que propunham que a matéria era formada por partículas indivisíveis, passando pelos modelos de Dalton no século XIX, Thomson e Rutherford no início do século XX, até chegar ao modelo atômico moderno com a descoberta do nêutron por Chadwick em 1932 e o desenvolvimento da mecânica quântica.
















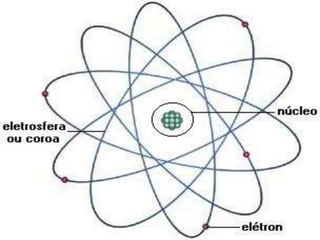








![•os orbitais não representam a posição exata
do elétron no espaço ( que não pode ser
determinada devido a sua natureza
ondulatória)
• delimitam uma região do espaço na qual a
probabilidade de encontrar o elétron é
elevada.[2]](https://image.slidesharecdn.com/estruturaatmica-110323111712-phpapp02/85/Estrutura-atomica-32-320.jpg)