Modelo atômico atual e partículas
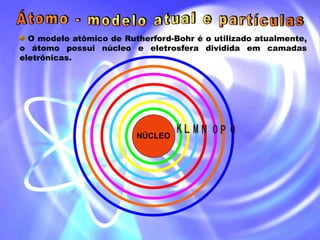
- 1. O modelo atômico de Rutherford-Bohr é o utilizado atualmente, o átomo possui núcleo e eletrosfera dividida em camadas eletrônicas. NÚCLEO
- 2. Núcleo: o núcleo é a parte central do átomo, onde se localizam os prótons e os nêutrons. NÊUTRON / PRÓTON +
- 3. Prótons (p+): os prótons são positivos, possuem número fixo no núcleo do átomo para cada elemento químico, não variam em número, portanto, um átomo não ganha e nem perde prótons. Se houver alteração no número de prótons muda-se o elemento químico. Os prótons identificam o átomo pelo fato de NÃO variarem em número (=NÚMERO ATÔMICO = Z). Possuem carga relativa +1 (são positivos). Têm massa relativa 1.
- 4. Nêutrons (n): os nêutrons não possuem carga, variam em número de um átomo para outro, mas não perdem nem ganham. Têm função básica de manter o núcleo do átomo coeso (unido), impedindo a repulsão das partículas positivas (prótons). Possuem carga relativa 0 (zero). Têm massa relativa 1.
- 5. a massa de um átomo concentra-se basicamente em seu núcleo, devido às massas relativas dos prótons e nêutrons. Para se encontrar o número de massa (A) de um átomo, soma-se número de prótons (número atômico – Z) com o número de nêutrons
- 6. A = Z + N A = P + N A =4 + 5 A = 9 Se um átomo tiver 4 prótons e 5 nêutrons
- 7. Eletrosfera: parte externa do átomo, onde se localizam os elétrons girando em torno do núcleo, em camadas distintas (7 camadas eletrônicas). NÚCLEO
- 8. • Elétrons (e-): os elétrons são negativos, variam em número na eletrosfera, pois um átomo pode ganhar ou perder elétrons. Sabendo que o número de elétrons pode variar, não são utilizados para identificar os átomos. • Possuem carga relativa –1 (são negativos). • Têm massa relativa 1/1836 ou 1/1840 (sua massa é desprezível).
- 9. Energia Cada elétron tem sua energia, que varia à medida que se afasta do núcleo do átomo, sendo crescente. Quanto mais distante do núcleo maior será a energia de um elétron.
- 10. ÍONS Íons: átomos em desequilíbrio elétrico, devido à perda ou ganho de elétrons. No caso de um átomo perder elétrons, por exemplo, ele irá adquirir automaticamente um excesso de carga positiva, pois a quantidade de prótons será maior que a de elétrons. Teremos então um ÍON CÁTION (POSITIVO) – geralmente os metais. Ex.: Lítio - Li 3 PRÓTONS 3 ELÉTRONS átomo de Li 3 PRÓTONS 2 ELÉTRONS íon Li+1
- 11. No caso de um átomo ganhar elétrons, por exemplo, ele irá adquirir automaticamente um excesso de carga negativa, pois a quantidade de elétrons será maior que a de prótons. Teremos então um ÍON Ex.: Flúor - F 9 PRÓTONS 9 ELÉTRONS átomo F 9 PRÓTONS 10 ELÉTRONS íon F-1 ÂNION (NEGATIVO) – geralmente os não metais.
- 12. NOTAÇÃO DE UM ÁTOMO XA Z A Z Xou Z = Número atômico A = Número de massa
- 13. YA Z X YA Z X Determina quantos elétrons o átomo ganhou. Determina quantos elétrons o átomo perdeu. Notação de Íons CÁTION ÂNION