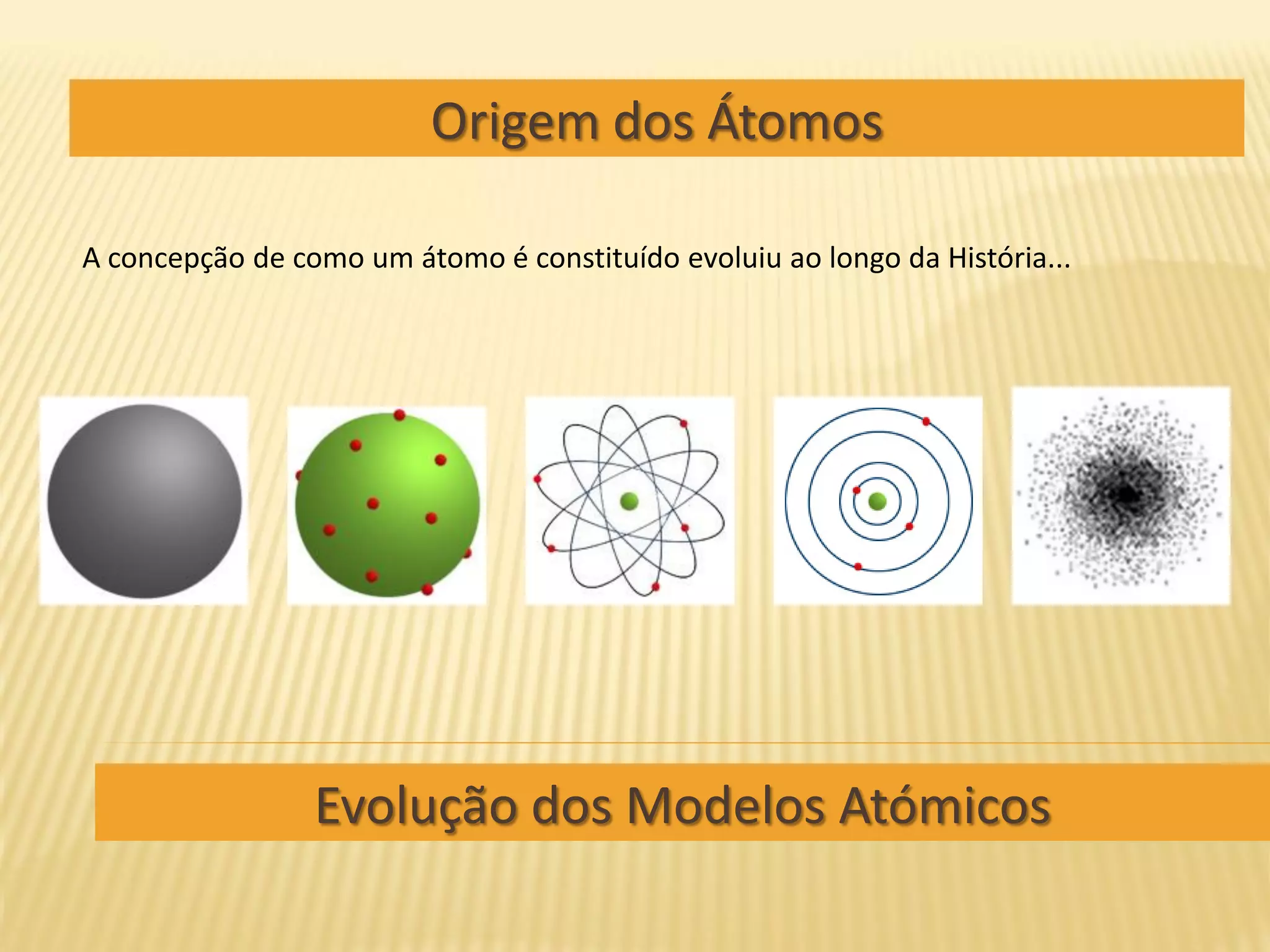
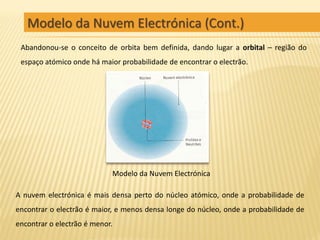
O documento descreve a evolução dos modelos atómicos ao longo da história, começando pelo modelo de Demócrito de partículas indivisíveis chamadas átomos, passando pelo modelo planetário de Rutherford com núcleo e elétrons orbitando, até chegar ao atual modelo quântico da nuvem eletrônica onde a posição dos elétrons é descrita por probabilidades.