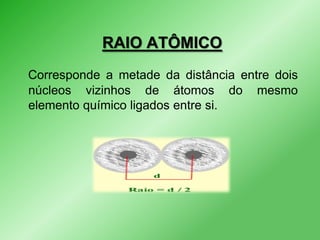
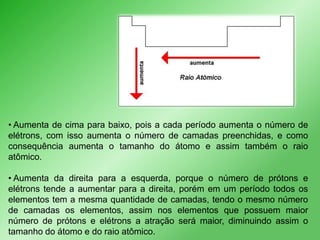
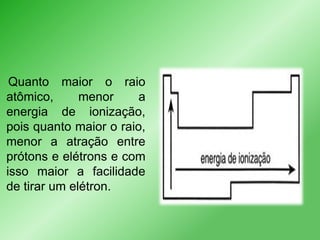
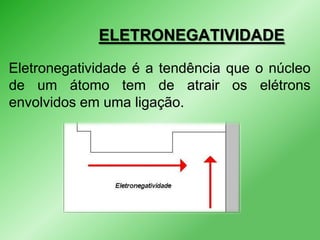
Este documento discute propriedades periódicas e aperiódicas na tabela periódica. Propriedades periódicas variam em períodos regulares, enquanto propriedades aperiódicas variam de forma irregular. Exemplos de propriedades periódicas incluem raio atômico, potencial de ionização e afinidade eletrônica. Propriedades como volume atômico e densidade também são discutidas.