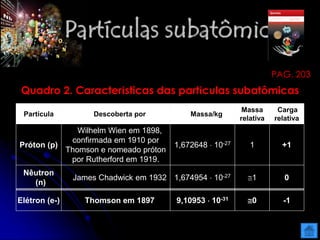
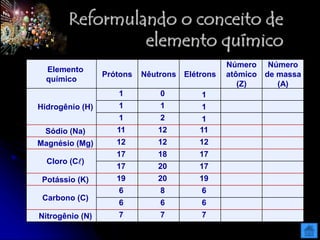
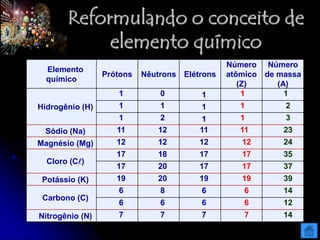
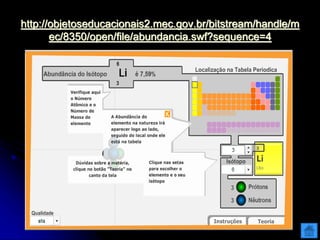
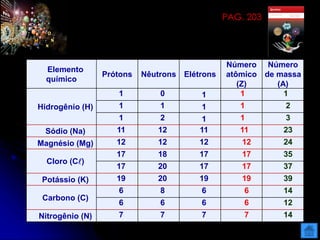
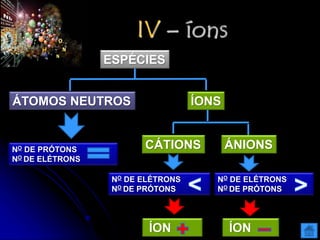
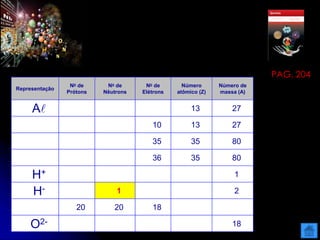
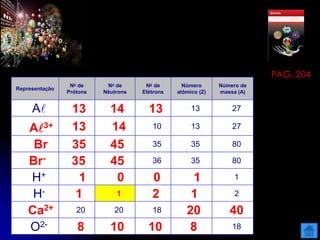
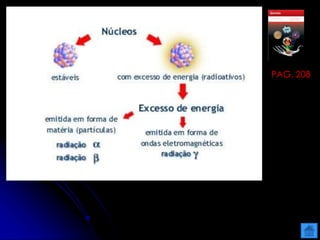
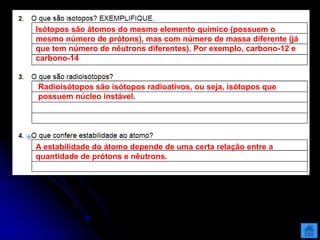
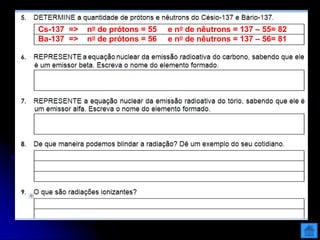
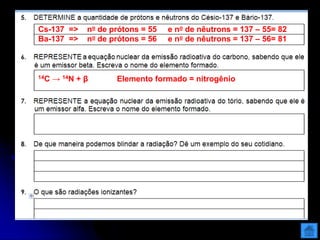
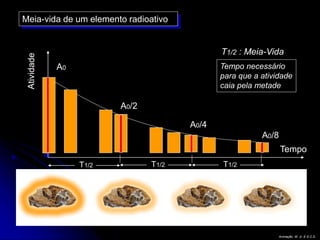
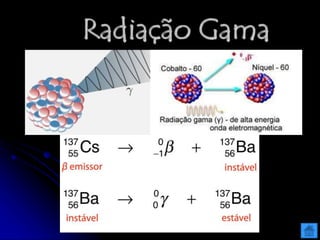
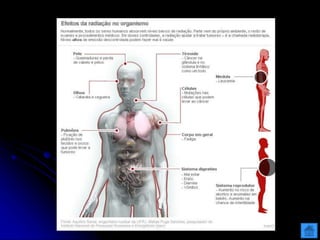
O documento resume as principais partículas subatômicas, como prótons, nêutrons e elétrons. Também discute a representação dos elementos químicos e conceitos como isótopos, íons, radioisótopos e suas propriedades. Explica os tipos de radiação ionizante como alfa, beta e gama e seus efeitos na matéria, além de conceitos como meia-vida radioativa.