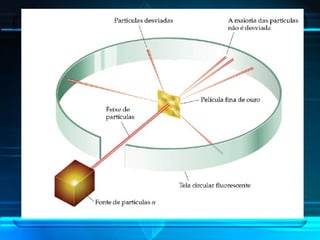
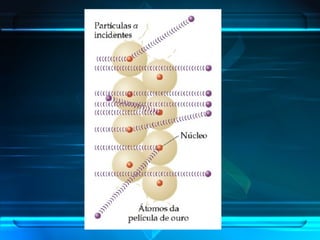
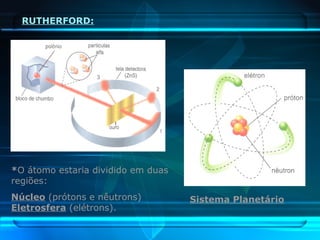
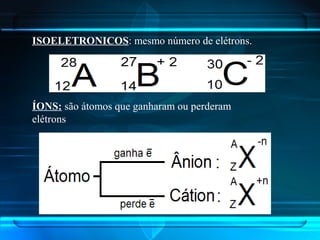
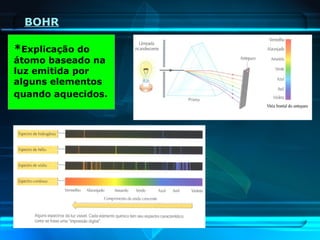
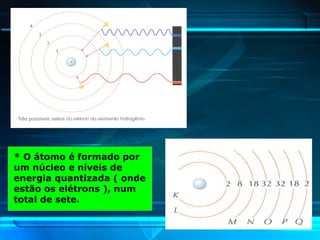
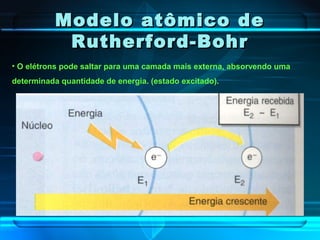
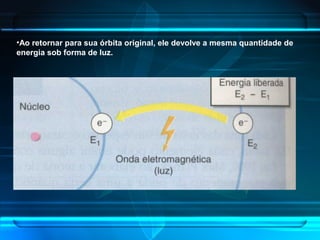
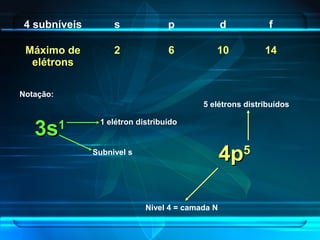
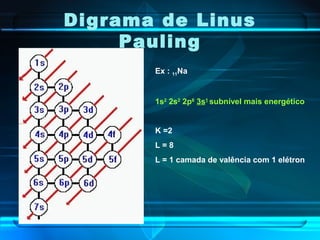
O documento descreve a evolução do modelo atômico ao longo da história, desde a ideia de átomos indivisíveis de Demócrito na Grécia Antiga até o modelo atômico de Rutherford-Bohr no início do século XX. Explica que o átomo é constituído por um núcleo central com prótons e nêutrons circundado por elétrons, e que estes ocupam níveis de energia quantizados. Também define conceitos como número atômico, número de massa e representação de átomos.