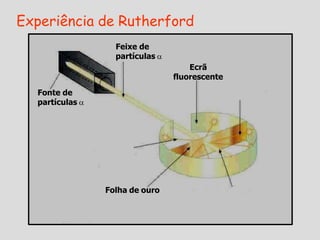
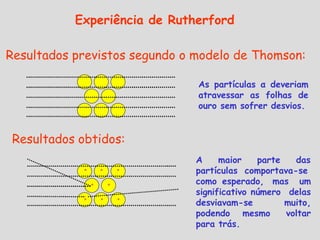
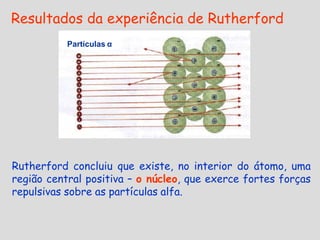
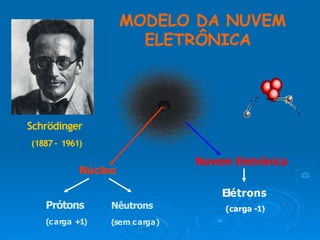
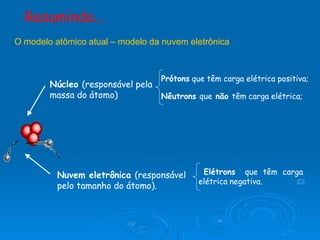
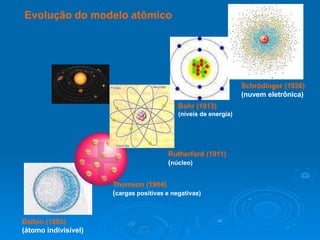
O documento descreve a evolução do modelo atômico ao longo do tempo, começando com as ideias de Demócrito e Leucipo na Grécia Antiga de que a matéria era composta por pequenas partículas indivisíveis chamadas átomos. Experimentos de Thomson, Rutherford, Bohr e Schrödinger no século XX levaram ao atual modelo atômico, no qual o átomo consiste em um núcleo denso rodeado por uma nuvem eletrônica, com prótons e nêutrons no núcleo e el