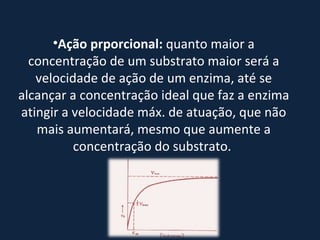
Enzimas são proteínas que catalisam reações biológicas, diminuindo a energia necessária. Elas podem ser classificadas por local de atuação ou composição química, e requerem cofatores para funcionar. Enzimas são específicas, reutilizáveis e podem atuar em direções reversíveis, com velocidade proporcional à concentração do substrato, podendo ser inibidas. A atividade enzimática depende de pH e temperatura ótimos.