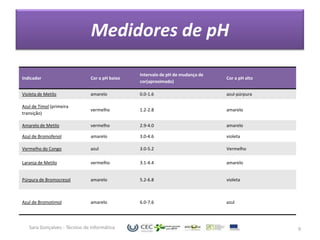
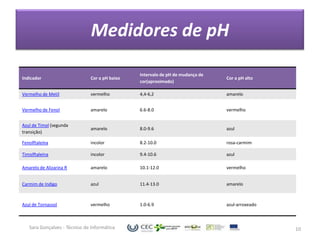
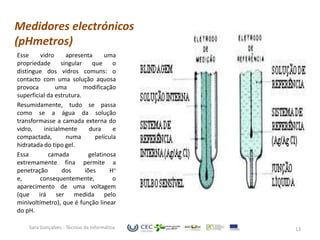
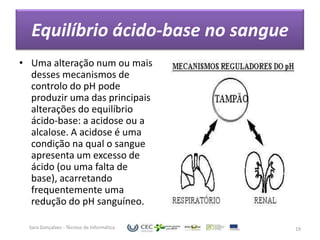
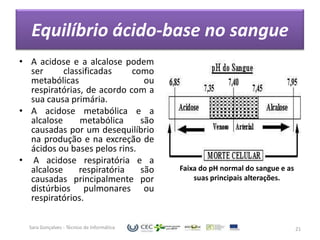
O documento discute o equilíbrio ácido-base no sangue, explicando que o sangue normalmente tem um pH levemente alcalino entre 7,35-7,45. O corpo controla esse equilíbrio através dos rins, soluções tampão e respiração, mas distúrbios nesses mecanismos podem levar a acidose ou alcalose.



![Cálculo do pH
• O valor do pH é calculado a partir da concentração de iões H+
presentes numa determinada solução, de acordo com a
seguinte expressão:
pH = -log[H+]
Sara Gonçalves - Técnico de Informática 4](https://image.slidesharecdn.com/cidosebases-121026155600-phpapp02/85/aCidos-e-bases-4-320.jpg)
![Cálculo do pH
• Onde o valor de pH representa o simétrico do logaritmo de
base 10 da concentração dos iões hidrogénio.
• Como se pode ver, o pH é dado por um número positivo. Se
não fosse o sinal menos a afectar o logaritmo, o pH seria um
número negativo devido aos valores normalmente muito
pequenos de [H+].
• Por exemplo, se [H+] = 0,01 mol/l pH= - (log 0,01)
pH = - (log 10-2)
pH = - (-2) = +2
Sara Gonçalves - Técnico de Informática 5](https://image.slidesharecdn.com/cidosebases-121026155600-phpapp02/85/aCidos-e-bases-5-320.jpg)
![Cálculo do pH
• Assim, tal como a constante de equilíbrio, o pH de uma
solução é uma quantidade adimensional.
• As soluções podem então ser consideradas ácidas ou básicas
consoante o valor do seu pH, o mesmo é dizer que têm mais
ou menos iões H+ em solução, respetivamente:
Soluções ácidas: [H+] > 1,0 x 10 -7 mol/l, pH < 7,00
Soluções básicas: [H+] < 1,0 x 10 -7 mol/l, pH > 7,00
Soluções neutras: [H+] = 1,0 x 10 -7 mol/l, pH = 7,00
Sara Gonçalves - Técnico de Informática 6](https://image.slidesharecdn.com/cidosebases-121026155600-phpapp02/85/aCidos-e-bases-6-320.jpg)