Incorporar apresentação
Baixado 23 vezes

![QUANTIFICANDO A RAPIDEZ DE
UMA REAÇÃO
• É uma grandeza que mostra como os reagentes e produtos variam com o
tempo.
• Essa grandeza é chamada de velocidade de reação ou Rapidez de
reação
• Para conseguirmos a velocidade média de um produto final ou velocidade
media de um consumo de um reagente podemos usar a expressão:
• Vm = [Δquantidade]
• Δtempo
• A Δquantidade deve ser representada como mol/l.](https://image.slidesharecdn.com/apresentao1-151015211339-lva1-app6892/85/Velocidade-de-reacao-3-320.jpg)







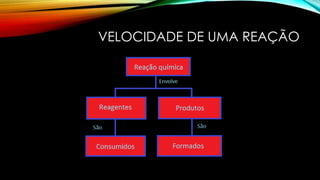
O documento discute a cinética química e quantifica a velocidade de reações. Explica que a velocidade de reação é medida pela variação de quantidade de reagentes e produtos ao longo do tempo, e que quanto maior a concentração dos reagentes, maior será a velocidade da reação, desde que haja colisão eficaz com energia suficiente para superar a barreira de ativação.


![QUANTIFICANDO A RAPIDEZ DE
UMA REAÇÃO
• É uma grandeza que mostra como os reagentes e produtos variam com o
tempo.
• Essa grandeza é chamada de velocidade de reação ou Rapidez de
reação
• Para conseguirmos a velocidade média de um produto final ou velocidade
media de um consumo de um reagente podemos usar a expressão:
• Vm = [Δquantidade]
• Δtempo
• A Δquantidade deve ser representada como mol/l.](https://image.slidesharecdn.com/apresentao1-151015211339-lva1-app6892/85/Velocidade-de-reacao-3-320.jpg)





