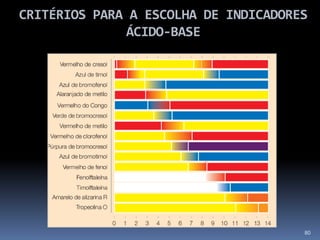
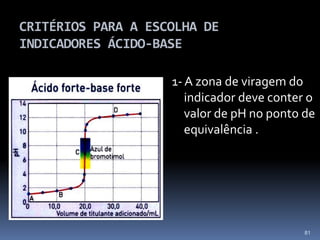
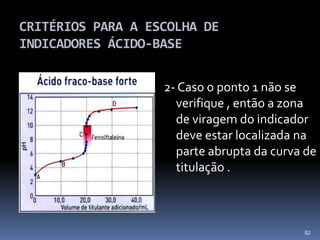
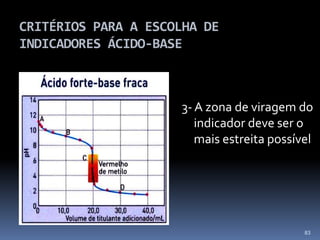
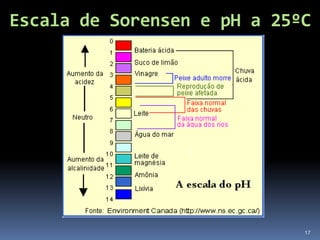
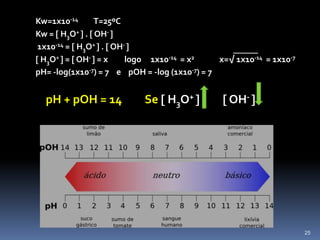
O documento discute ácidos, bases e suas teorias, incluindo:
1) A teoria de Arrhenius define ácidos e bases como substâncias que dissociam em H+ e OH- em solução aquosa.
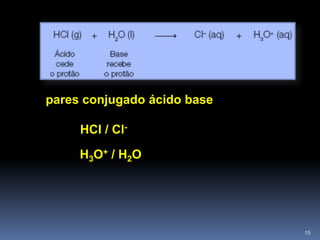
2) A teoria de Bronsted-Lowry generaliza a definição para transferência de prótons entre uma substância doadora (ácido) e receptora (base).
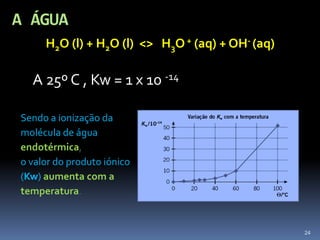
3) A água pode agir como ácido ou base devido à sua autoionização em H3O+ e OH-.


















![Ex: [H3O+] = 2x10-5 pH= -log(2x10-5) pH=4,7[OH-] = 7x10-5 pOH= -log(7x10-5) pOH=4,2Se pH=2,2 qual a concentração de iões [H3O+] ? [H3O+] = 10-pH =10-2,2 = 6,3x10-3 mol/dm321](https://image.slidesharecdn.com/2-cido-base-11-110222144433-phpapp01/85/acido-base-21-320.jpg)












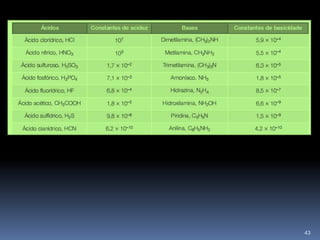
![CONSTANTE DE ACIDEZ (Ka)É a constante de equilíbrio de uma reacção em que um ácido sofre ionizaçãoHA (aq) + H2O (l) <> A- (aq) + H3O + (aq) A - . H3O+ ]Ka = HA Em soluções diluídas a quantidade de água é constante.34](https://image.slidesharecdn.com/2-cido-base-11-110222144433-phpapp01/85/acido-base-37-320.jpg)




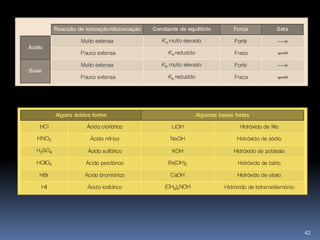
![pH - SOLUÇÕES DE ÁCIDOS FRACOSA ionização de um ácido fraco é parcial :HA (aq) + H2O (l) A- (aq) + H3O + (aq)pH = - log H3O+total onde : H3O+total= H3O+ácido + H3O +águaNormalmente despreza-se a [H3O+] da água41](https://image.slidesharecdn.com/2-cido-base-11-110222144433-phpapp01/85/acido-base-44-320.jpg)