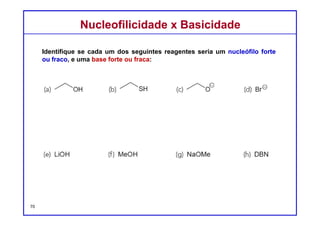
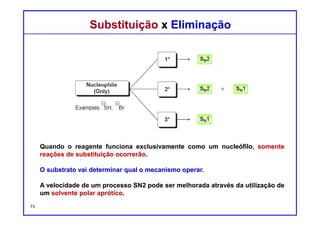
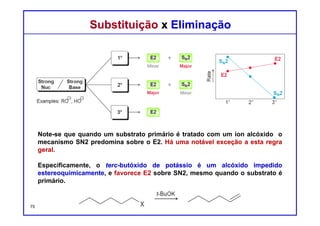
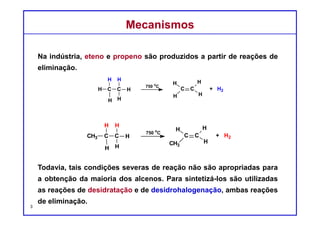
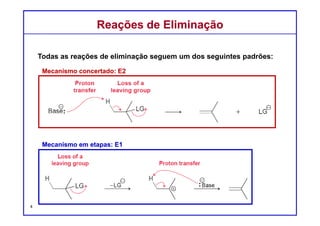
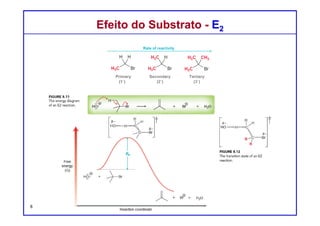
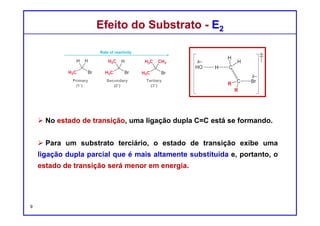
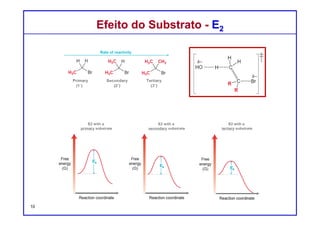
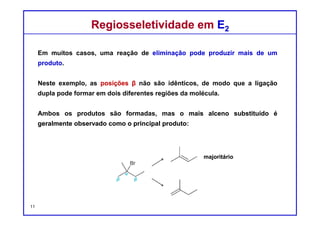
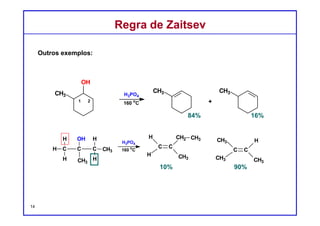
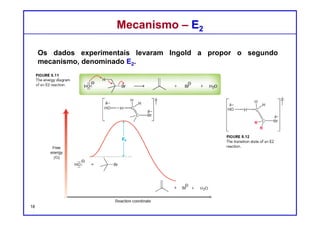
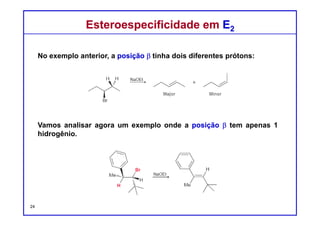
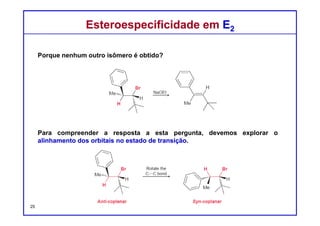
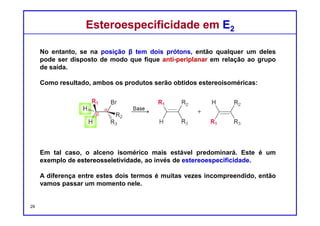
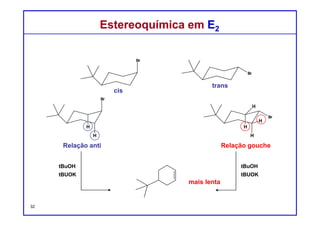
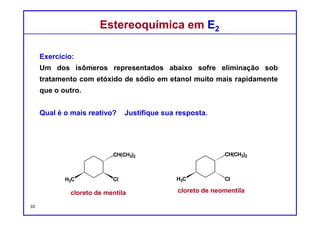
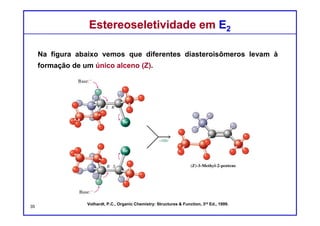
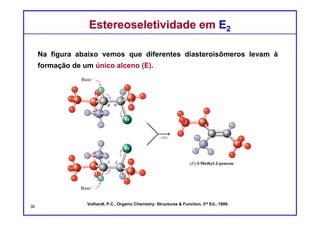
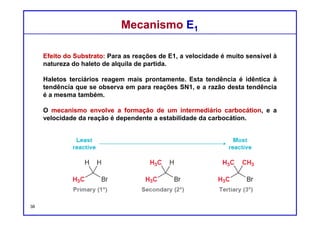
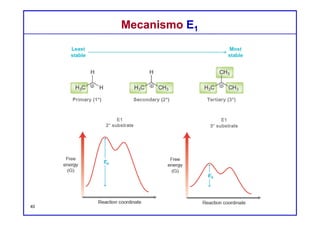
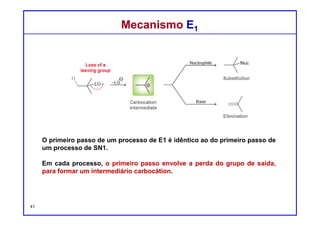
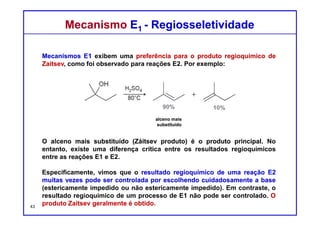
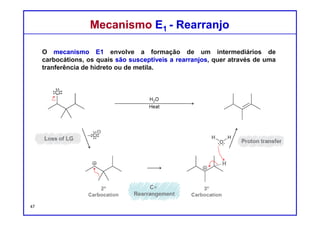
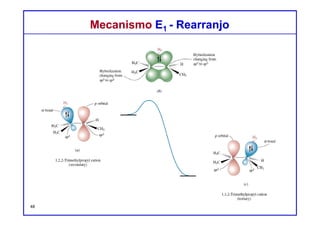
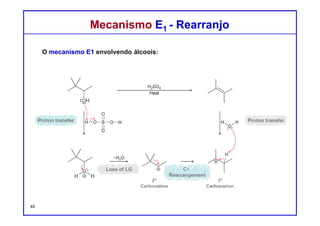
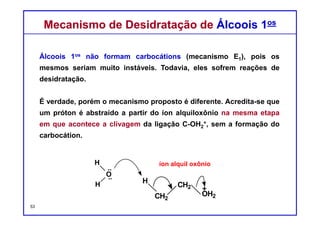
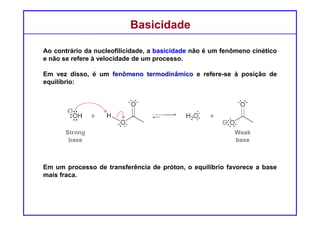
O documento discute reações de eliminação, onde um próton e um grupo abandonador são removidos para formar uma ligação dupla. Existem dois mecanismos possíveis para eliminação - E1 e E2. A reação E2 segue uma cinética de segunda ordem e envolve um estado de transição concertado, enquanto E1 é um processo de dois passos. A estereoquímica e a regioquímica das reações de eliminação são também discutidas.


![DQOI - UFC Prof. Nunes
DQOI - UFC Prof. Nunes
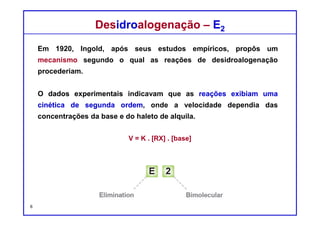
Estudos cinéticos mostram que muitas reações de eliminação apresentam
uma cinética de segunda ordem com uma velocidade de reação:
V = K [substrato] [base]
Isto é consistente com um mecanismo concertado em que existe apenas
uma etapa mecanística, envolvendo tanto o substrato como a base. Uma vez
que este passo envolve duas entidades químicas, dizemos ser bimolecular.
Mecanismo E2 - Evidência CinéticaMecanismo E2 - Evidência Cinética
5
transferência de
próton
saída do grupo
abandonador
E2
Eliminação Bimolecular](https://image.slidesharecdn.com/unidade03-elim16-160705145833/85/Reacoes-de-Eliminacao-5-320.jpg)















![DQOI - UFC Prof. Nunes
DQOI - UFC Prof. Nunes
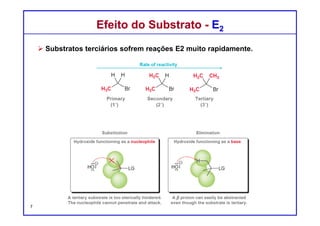
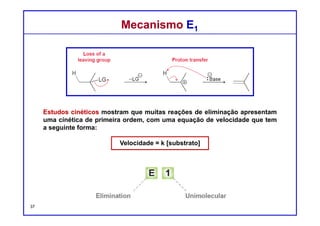
Mecanismo E1Mecanismo E1
Estudos cinéticos mostram que muitas reações de eliminação apresentam
uma cinética de primeira ordem, com uma equação de velocidade que tem
a seguinte forma:
Velocidade = k [substrato]
34
Eliminação Unimolecular](https://image.slidesharecdn.com/unidade03-elim16-160705145833/85/Reacoes-de-Eliminacao-34-320.jpg)
















![DQOI - UFC Prof. Nunes
DQOI - UFC Prof. Nunes
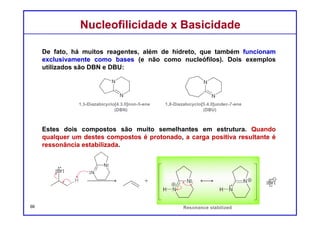
De fato, há muitos reagentes, além de hidreto, que também funcionam
exclusivamente como bases (e não como nucleófilos). Dois exemplos
utilizados são DBN e DBU:
Estes dois compostos são muito semelhantes em estrutura. Quando
qualquer um destes compostos é protonado, a carga positiva resultante é
estabilizada por ressonância.
65
Estabilizado por ressonância
1,5-diazobibiclo[4.3.0]non-5-eno
(DBN)
1,8-diazobibiclo[5.4.0]undec-7-eno
(DBU)
Nucleofilicidade x BasicidadeNucleofilicidade x Basicidade](https://image.slidesharecdn.com/unidade03-elim16-160705145833/85/Reacoes-de-Eliminacao-65-320.jpg)