O documento discute os conceitos de ácidos e bases de acordo com as teorias de Arrhenius, Brønsted-Lowry e Lewis. Ele explica como fatores como tamanho do átomo, eletronegatividade, efeitos indutivos e ressonância afetam a acidez de compostos. Além disso, apresenta a equação de Henderson-Hasselbalch e como calcular valores de pKa.



![Prof. Gustavo
Química Orgânica Teórica 1B
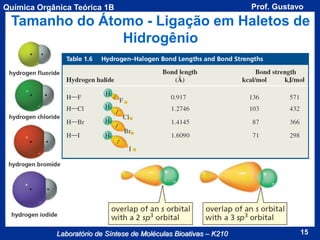
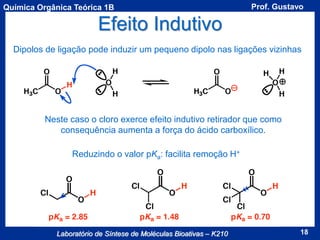
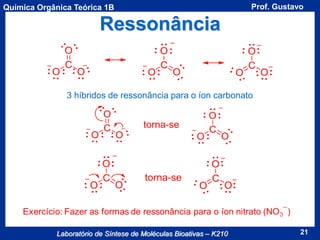
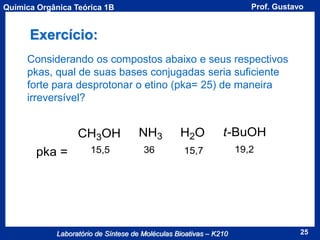
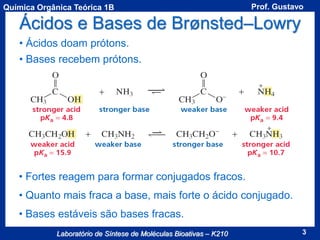
Acidez de um Composto
A acidez de um composto é dada pela seu valor de pKa
Equilíbrio Ácido/Base
Ka: Constante de
dissociação do ácido
Permanece constante
[H2O] =
1000g
= 55,56
18g/mol x 1L
Laboratório de Síntese de Moléculas Bioativas – K210
5](https://image.slidesharecdn.com/aula4-5acidosebasesefeitoseletrnicos-131122201712-phpapp01/85/Aula-4-5-acidos-e-bases-efeitos-eletronicos-5-320.jpg)


![Prof. Gustavo
Química Orgânica Teórica 1B
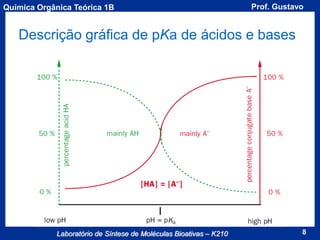
Calculando o pKa do H3O+
[H2O] =
1000g
= 55,56
18g/mol x 1L
pKa (H3O)+ = - log(55,56) = -1,74
Portanto, ácidos com pKa menor que -1,74 protonarão a
água completamente.
Laboratório de Síntese de Moléculas Bioativas – K210
9](https://image.slidesharecdn.com/aula4-5acidosebasesefeitoseletrnicos-131122201712-phpapp01/85/Aula-4-5-acidos-e-bases-efeitos-eletronicos-9-320.jpg)