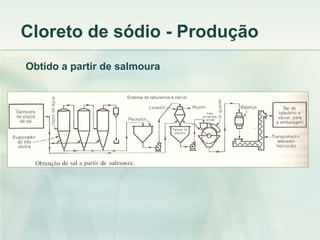
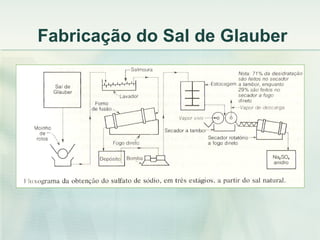
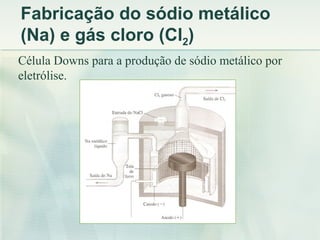
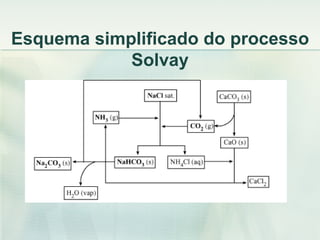
O documento descreve vários compostos de sódio e seus derivados, incluindo suas propriedades, métodos de produção e usos industriais. Detalha o cloreto de sódio, sulfato de sódio, bissulfito de sódio, entre outros, assim como os processos de produção de sódio metálico, soda cáustica e cloro.