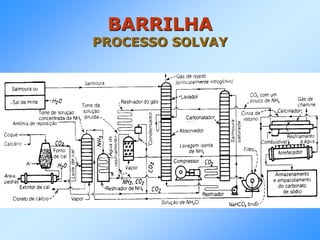
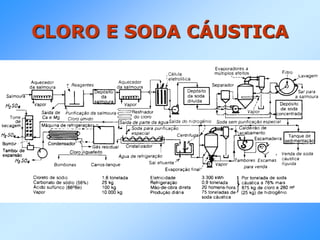
Este documento resume os principais processos industriais de produção de barrilha, cloro e soda cáustica, bem como sua aplicação em diversos outros produtos químicos e indústrias. Aborda os processos LeBlanc e Solvay para a produção de barrilha, o processo eletrolítico para a produção de cloro e soda cáustica, e as reações químicas envolvidas.