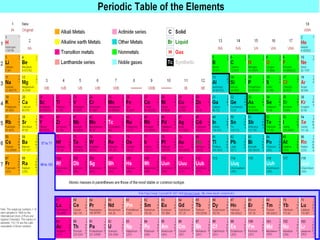
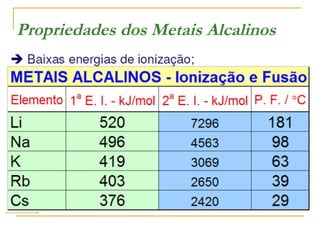
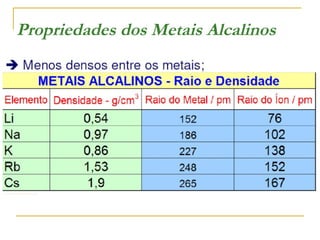
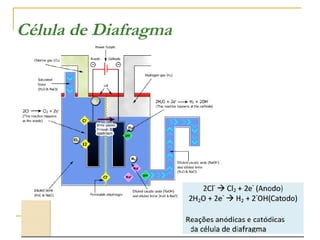
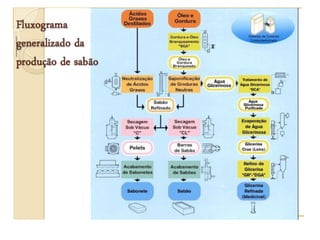
O documento discute as propriedades dos metais alcalinos, incluindo litio, sódio, potássio e frâncio. Aborda suas características químicas, como reatividade com água e oxigênio, e propriedades físicas, como solubilidade e cor de compostos. Também explica como esses metais são obtidos industrialmente por eletrólise e seus usos principais, como na fabricação de sabão, papel e detergentes.