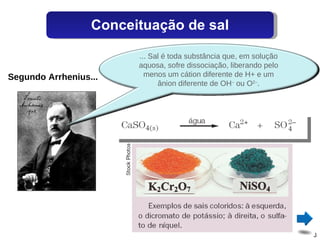
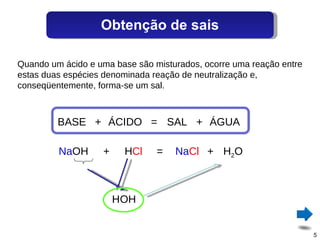
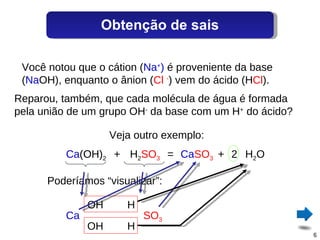
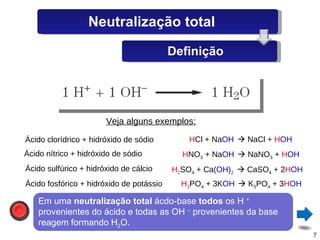
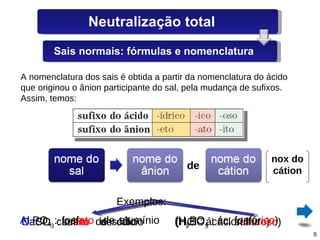
O documento discute sais, definindo-os como substâncias que liberam cátions e ânions quando dissolvidas em água. Explica como sais são formados por reações de neutralização entre ácidos e bases, e descreve alguns sais comuns como o cloreto de sódio, sulfato de cálcio e seus usos.