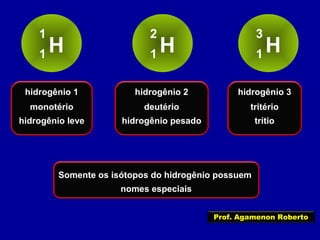
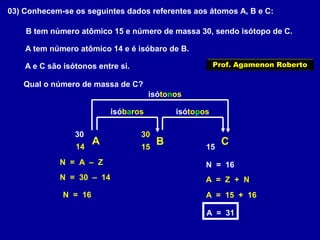
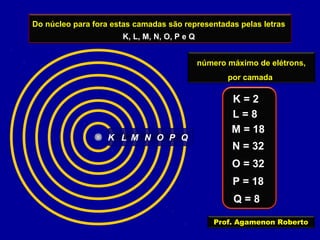
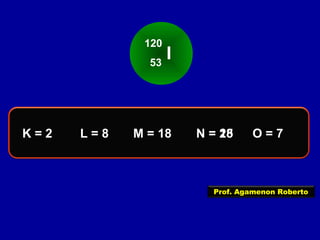
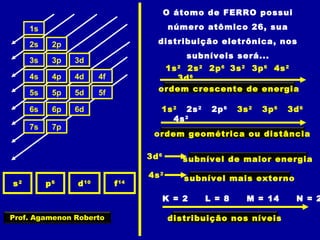
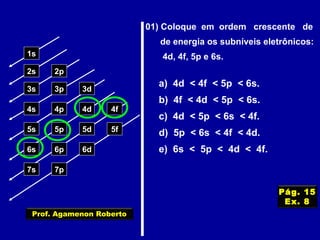
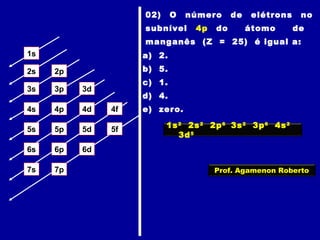
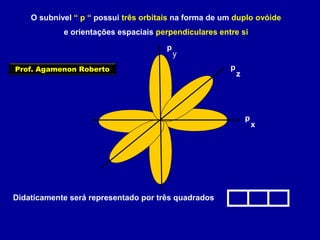
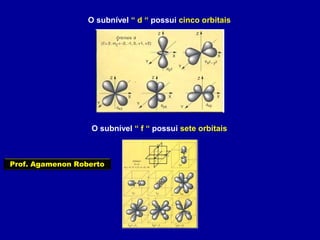
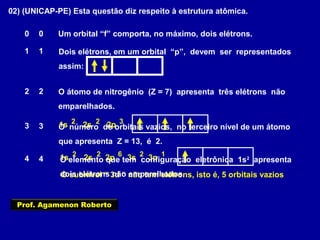
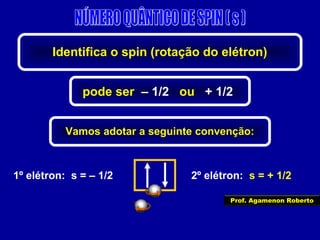
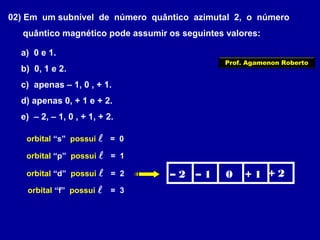
Este documento fornece informações sobre as partículas subatômicas (prótons, nêutrons e elétrons) que compõem os átomos e sobre como os átomos são identificados e classificados de acordo com o número de prótons, nêutrons e elétrons. Explica os conceitos de número atômico, número de massa, elementos químicos, isótopos, isóbaros e isotônicos.