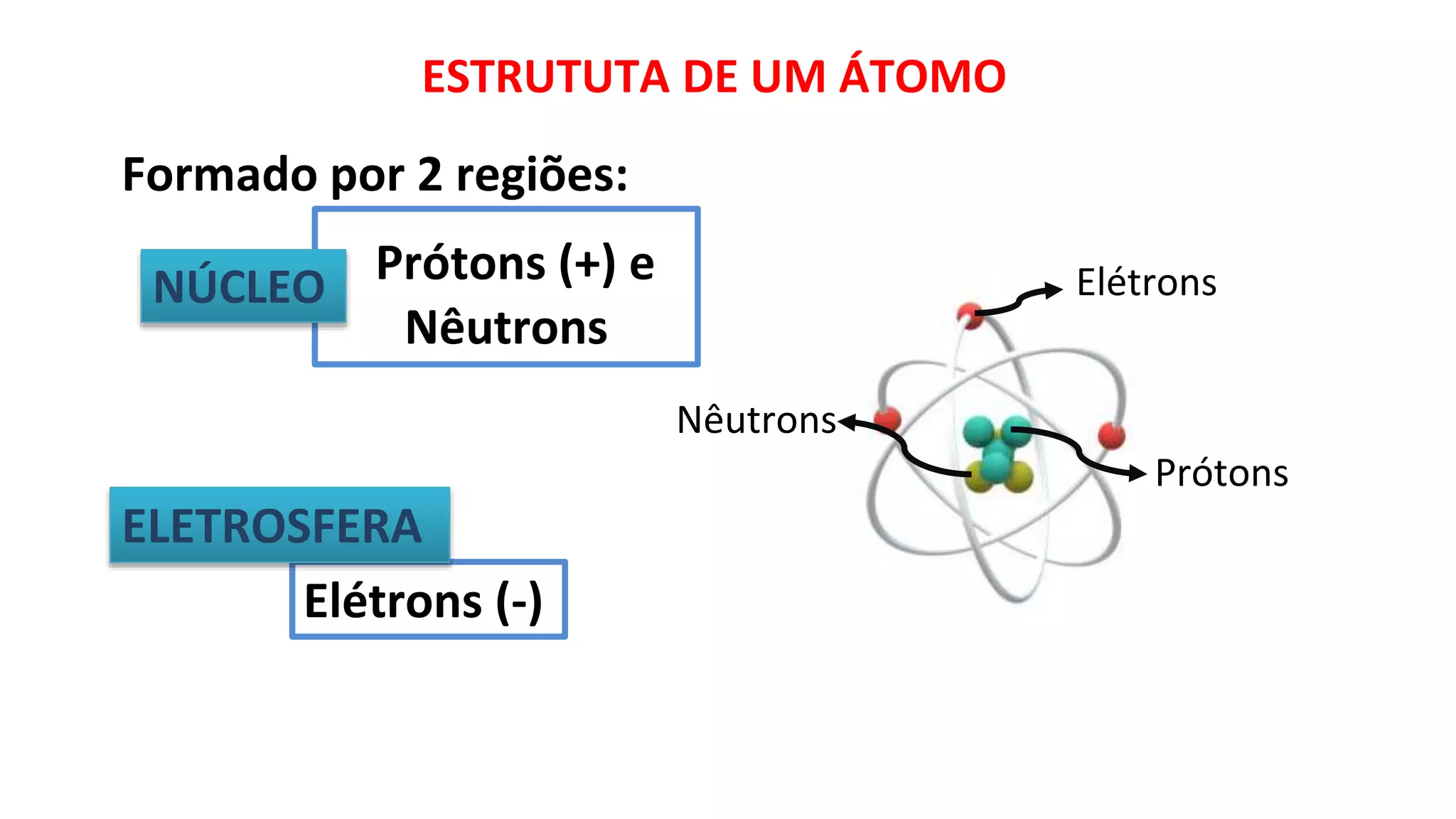
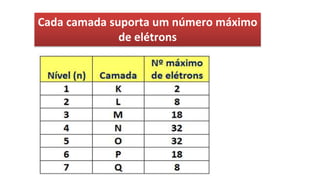
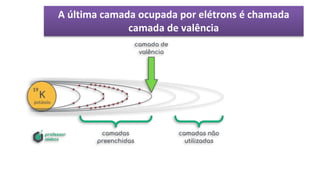
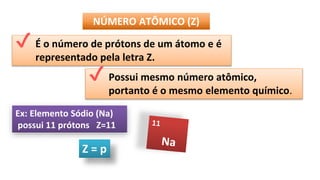
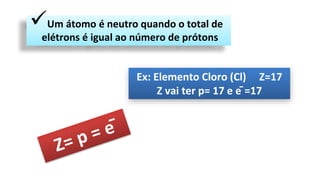
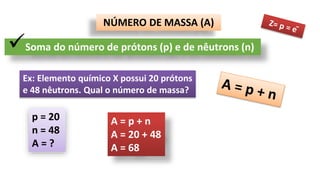
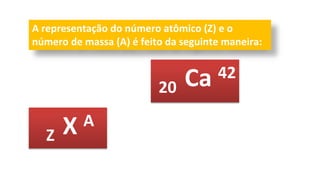
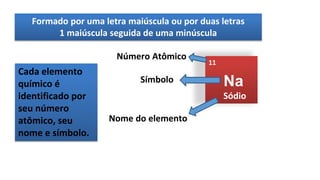
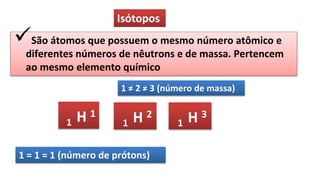
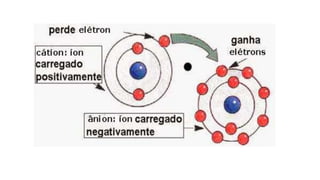
O documento descreve a estrutura de um átomo, que é formado por prótons e nêutrons no núcleo e elétrons na eletrosfera. Os elétrons estão distribuídos em camadas eletrônicas que podem ter até 7 níveis. O número atômico representa o número de prótons e define o elemento químico. O número de massa é a soma de prótons e nêutrons.