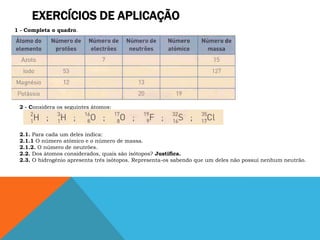
O documento explica como identificar elementos químicos através do número atômico e número de massa de seus átomos. O número atômico indica o número de prótons e o elemento. O número de massa indica o número total de prótons e nêutrons. A diferença entre esses números revela a quantidade de nêutrons, e isótopos são átomos do mesmo elemento com diferentes quantidades de nêutrons.