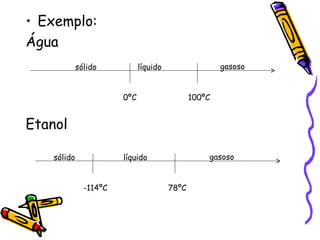
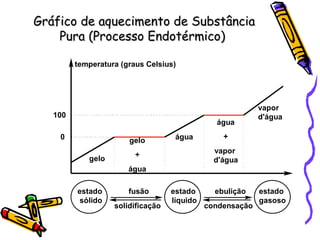
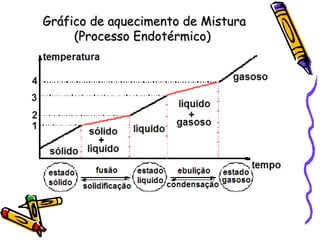
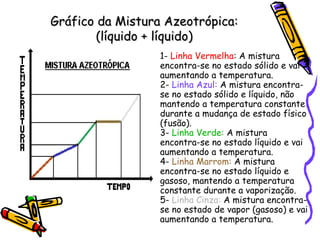
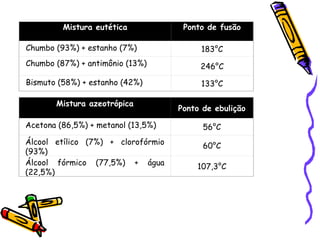
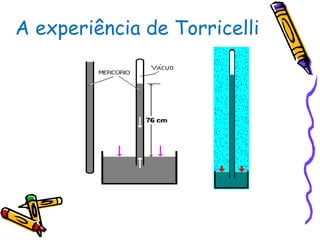
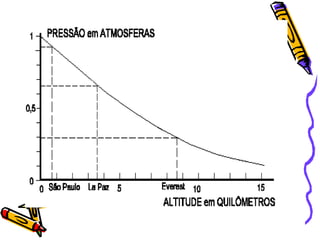
O documento discute propriedades específicas da matéria como pontos de fusão e ebulição e como eles variam entre substâncias puras, misturas e com a pressão atmosférica. Explica que a temperatura se mantém constante durante as mudanças de estado nas substâncias puras, mas não em misturas, e que a pressão atmosférica afeta os pontos de fusão e ebulição.