Este capítulo discute dois tipos de sistemas em equilíbrio: equilíbrios de fases, que envolvem a mesma substância em estados físicos diferentes, e equilíbrios de soluções moleculares. O capítulo se concentra no equilíbrio entre a água líquida e seu vapor, explicando que a água pode existir nos três estados a qualquer temperatura e que a concentração da água líquida é constante. Também discute a pressão de vapor da água e como afeta processos como a ebulição.




![CAPÍTULO 13
consequentemente mais rápido. Isto chama-se tecnologia, que é exatamente o emprego
da ciência para fins práticos.
Esse processo de passagem da água do estado líquido para o estado gasoso, que, como
falamos, acontece a qualquer temperatura, é muito importante no ciclo de água da terra.
A água está sempre se evaporando. Como consequência a atmosfera tem bastante água
em sua composição. Vamos examinar este importante aspecto mais de perto.
À temperatura ambiente, 25 °C, a pressão de vapor da água é de 23,8 mm de Hg, ou
seja, 0,0313 atmosferas, que será então a pressão parcial máxima, ou de equilíbrio, do
vapor d’água na atmosfera. Nesta circunstância a concentração de H2O (g) na atmosfera
pode ser calculada pela equação pV=nRT, sendo então [H2O(g)] = p/RT, ou seja,
0,0313/0,082x298=1,28 x 10-3 mol/L. Isto equivale a 1,28x10-3 mol/L x 18 g/mol = 0,023 g
de H2O(g) por litro de ar.
Com esta quantidade de H2O(g) no ar, o ar está saturado de água. Neste caso a umidade
relativa do ar é de 100%. Nuvens se formarão, levando eventualmente a chuvas.
Mas, a capacidade do ar de absorver água é uma função da temperatura. Se o ar estiver
perto do valor de saturação, e a temperatura cai, temos nevoeiros, ou seja, gotículas de
água líquida suspensas no ar.
Mas o sistema água/atmosfera não pode ser considerado um sistema fechado onde
necessariamente um equilíbrio se estabelece. Normalmente tem muito menos água do
que isto no ar. É comum em muitos lugares no Brasil, termos valores frequentemente
perto 80% de umidade relativa do ar. Por outro lado, em muitos lugares, e em certas
épocas do ano, os valores da umidade relativa do ar ficam desconfortavelmente baixos
(ar muito seco) a ponto de escolas serem fechadas.
Umidade relativa do ar é uma grandeza com que convivemos no nosso dia-a-dia e
que precisamos saber o que significa. Podemos definir umidade relativa do ar como se
segue:
Ou
Todo líquido tem uma pressão de vapor característica.
Quanto mais volátil, ou seja, quanto menor o ponto de ebulição do líquido, tanto maior a
pressão de vapor do mesmo a uma dada temperatura.
397](https://image.slidesharecdn.com/equilibriodefases-131103115727-phpapp02/85/Equilibrio-de-fases-7-320.jpg)




![FUNDAMENTOS DE QUÍMICA GERAL
guelras. E não existindo estes seres aquáticos, provavelmente a vida de seres terrestres
também não teria se desenvolvido.
A dissolução do gás oxigênio em água pode ser representada pela equação:
→
O2(g) → O2(aq)
A expressão de equilíbrio pode ser escrita:
Mas, ao contrário do que acontece com sólidos e líquidos puros, os gases têm volumes
muito variáveis, dependendo das condições de pressão e temperatura, variando também
a densidade. Assim sendo, a concentração de gases puros não é constante, e portanto
nossa expressão fica como está.
Entretanto, é muito mais prático expressar este equilíbrio de uma forma mista, pois a
concentração de um gás contido num determinado volume é proporcional à pressão do
mesmo.
Sabemos que PV=nRT. Então P=(n/V)RT.
Mas n/V é concentração, Assim, para o oxigênio P =[O2(g)] RT, ou se o oxigênio fizer parte
de uma mistura de gases, como o ar por exemplo, teremos:
onde o p é a pressão parcial do oxigênio na mistura.
Podemos então escrever a importantíssima expressão:
Que expressa a solubilidade do gás oxigênio em função da pressão parcial que o gás
exerce sobre a água onde está sendo dissolvido.
Esta equação é uma expressão matemática para a famosa lei de Henry (William Henry –
1734-1816) e pode ser generalizada para qualquer gás que não reaja quimicamente com
a água (como é o caso de gás carbônico, por exemplo).
Esta equação normalmente é escrita:
Que nos diz que a solubilidade de um gás é diretamente proporcional à pressão parcial
excercida por este gás sobre a solução.
402](https://image.slidesharecdn.com/equilibriodefases-131103115727-phpapp02/85/Equilibrio-de-fases-12-320.jpg)


![CAPÍTULO 13
Pelo princípio de Lê Chatelier pode-se deduzir que ao se aumentar a pressão, aumentase a concentração de CO2, e logo aumenta a solubilidade do mesmo, e o equilíbrio será
deslocado para a formação do acido fraco H2CO3.
E, se por outro lado, a pressão sobre a solução diminuir, o equilíbrio será deslocado para
a esquerda, ou seja na direção da formação do gás carbônico.
É o que acontece quando se abre uma garrafa de refrigerante, que é engarrafado sobre
pressão ao se injetar no mesmo gás carbônico, causando a saída e perda do gás.
RESPOSTAS AOS EXERCÍCIOS DENTRO DO CAPÍTULO
13.1. Tarefa
13.2. Kc = [C4H10 (g)] e Kp = pvap = pC4H10 (g)
13.3. Igual nos dois, pois Kp = pvap do propano e do butano, e é independente da
quantidade (a concentração do líquido é constante) da fase líquida.
13.4. (1) 7,23 x 10-4 mol. L-1.atm-1 x 0,78 atm = 5,64 x 10-4 mol/L
(2) 7,23 x 10-4 mol. L-1.atm-1 x 6 x 0,78 atm = 3,38 x 10-3 mol/L
(3) Diferença de solubilidades = 2,82 x 10-3 mol/L x 4,5 L = 0,0127 mol de N2, que será
expelido a uma temperatura de 25oC (298 K) e uma pressão de 1 atmosfera. Logo V=0,31
L ou 310 mL.
EXERCÍCIOS COMPLEMENTARES - CAPÍTULO 13
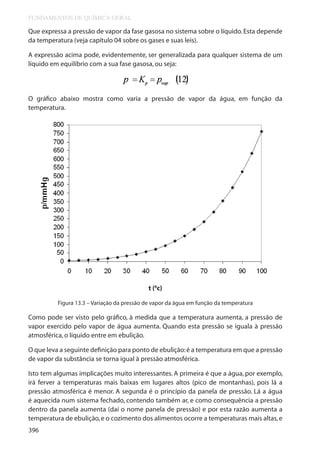
1. A 25 oC a capacidade do ar de reter água no estado gasoso é de 0,023 g/L. Com esta
quantidade de água gasosa misturada com os outros gases atmosférico temos uma
umidade relativa do ar de 100%. Nesta circunstância qual será a pressão parcial exercida
pelo H2O (g)? Confira o seu resultado com o gráfico da figura 13.3.
2. Por que a água ferve a temperaturas mais altas numa panela de pressão?
3. A presença de água no ar é essencial para uma vida confortável. Quando a umidade
relativa do ar cai abaixo de 30 %, temos uma situação de emergência que ocasiona até
suspensão de aulas. Nestas circunstâncias qual é a massa de água presente em cada litro
de ar?
4. Sólidos possuem pressão de vapor muito menor do que os líquidos. Mesmo assim,
alguns sólidos têm pressão de vapor apreciável. Seja, por exemplo, a substância naftaleno
(nome popular naftalina) usando no combate às traças, e cuja fórmula é C10H8. A pressão
de vapor deste sólido é de 1,04 x 10-4 atm, ou 0,079 mmHg, a 25 oC.
405](https://image.slidesharecdn.com/equilibriodefases-131103115727-phpapp02/85/Equilibrio-de-fases-15-320.jpg)
