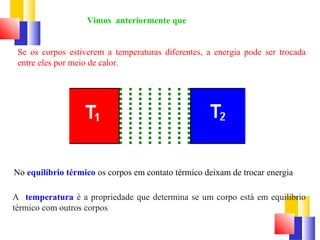
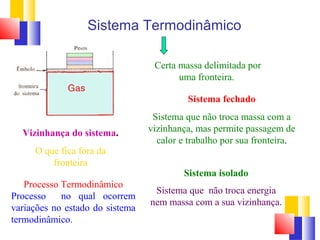
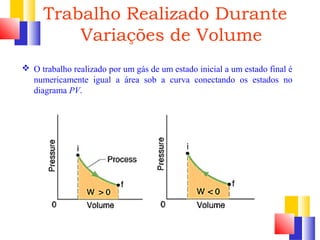
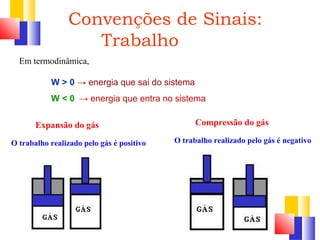
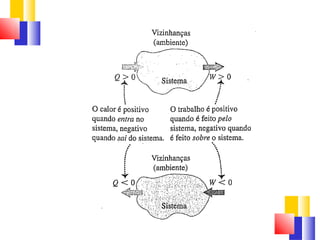
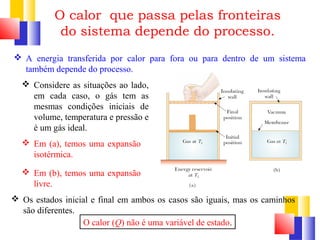
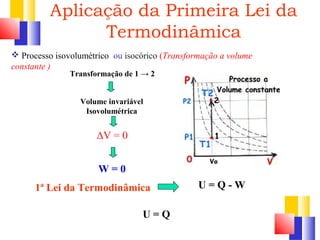
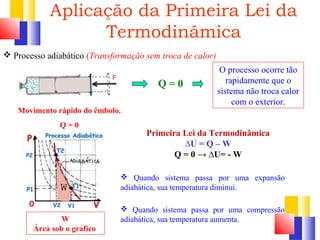
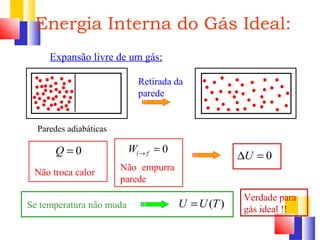
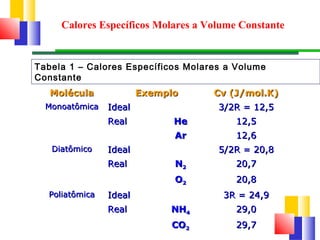
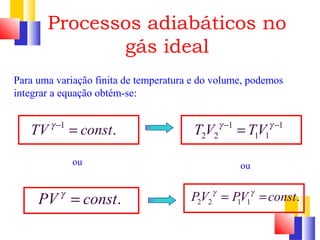
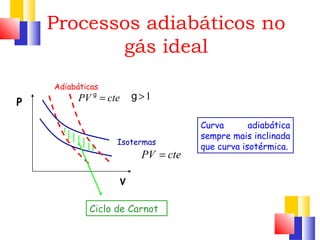
O documento discute a Primeira Lei da Termodinâmica, explicando que ela é uma generalização da lei da conservação de energia que inclui mudanças na energia interna de um sistema. A Primeira Lei estabelece que a variação na energia interna de um sistema é igual à quantidade de calor adicionado menos o trabalho realizado. Exemplos ilustram como aplicar a lei a diferentes processos termodinâmicos.