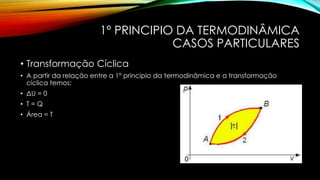
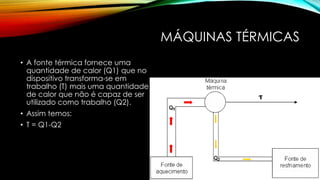
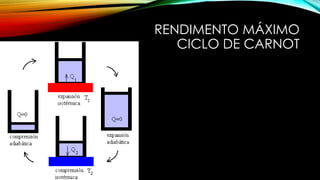
A termodinâmica estuda os efeitos da mudança de temperatura, volume e pressão em sistemas físicos. Explica como a energia térmica realiza trabalho e apresenta dois princípios: 1) a energia não pode ser criada ou destruída, apenas transferida ou armazenada como trabalho ou calor; 2) o calor não flui espontaneamente de corpos mais frios para mais quentes.