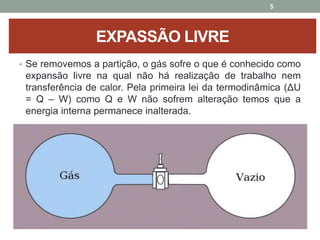
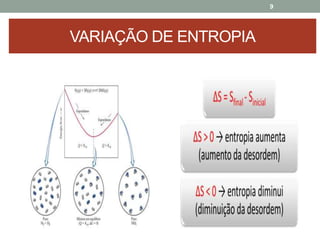
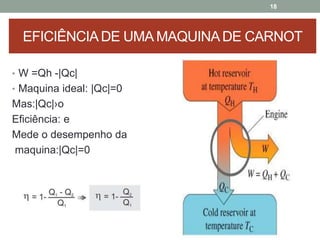
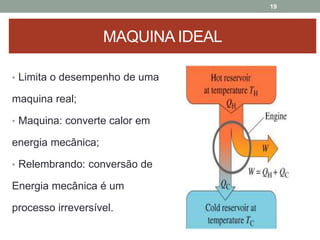
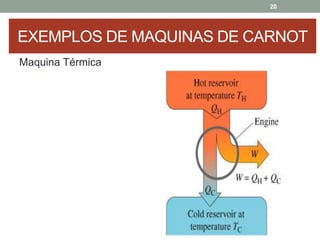
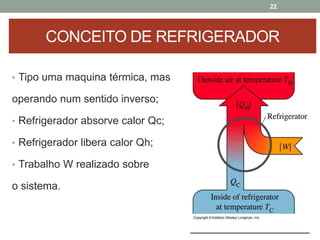
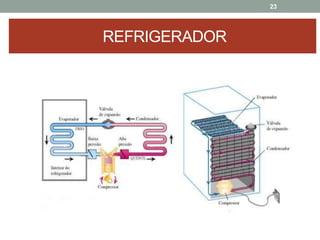
O documento discute os conceitos de entropia e segunda lei da termodinâmica. Apresenta os processos irreversíveis e reversíveis e explica que a entropia está relacionada ao grau de desordem de um sistema. A segunda lei estabelece que a entropia de um sistema isolado nunca diminui durante uma transformação natural.