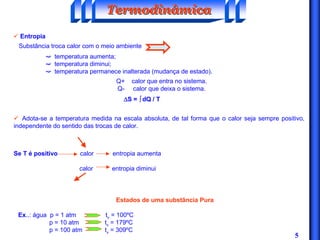
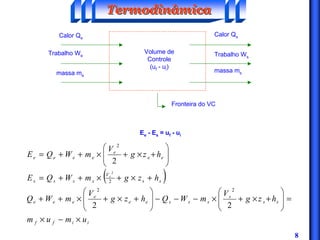
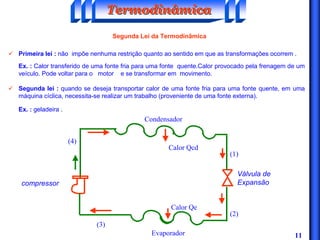
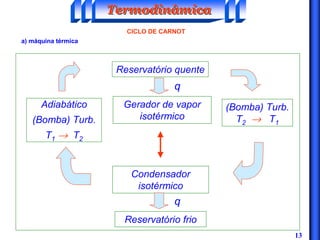
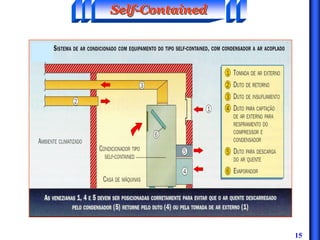
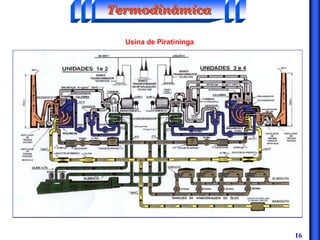
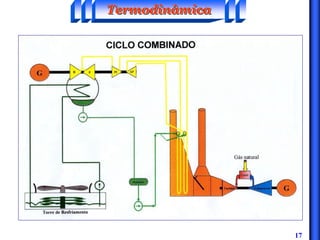
O documento discute os principais conceitos da termodinâmica, incluindo: (1) volume de controle e propriedades termodinâmicas como pressão e temperatura; (2) primeira lei da termodinâmica sobre conservação de energia; (3) segunda lei da termodinâmica sobre entropia e impossibilidade de transformar totalmente calor em trabalho.

![2
Gás
Compressão
Trabalho
Fronteira
móvel
Gás
Trabalho
Expansão
TermodinâmicaTermodinâmicaTermodinâmica
Calor
Forma de energia que se transfere entre dois pontos, devido a uma diferença de temperatura entre
eles.
ü Propriedades Termodinâmicas
a) Massa Específica (ρ ) ρ = m / V , [kg / m3 ]
b) Pressão (P) P = dF / dA , [N / m2]](https://image.slidesharecdn.com/termodinmica-130421084847-phpapp01/85/Termodinamica-2-320.jpg)