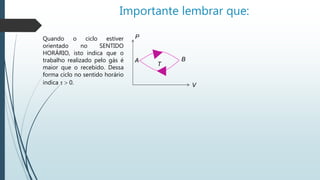
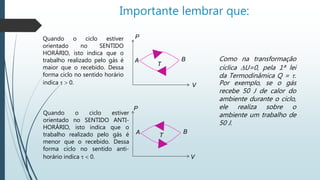
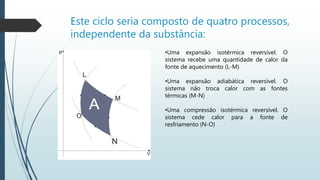
Uma transformação cíclica de um gás envolve uma sequência de transformações que retorna o gás ao seu estado inicial de pressão, temperatura e volume. O documento descreve um ciclo ABCDA de um gás, incluindo as etapas de expansão e compressão isobárica e transformações isocóricas, além de explicar a relação entre trabalho e calor em um processo cíclico.