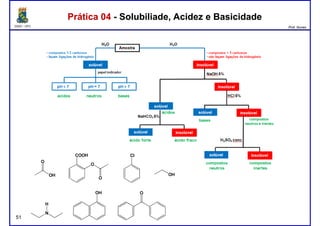
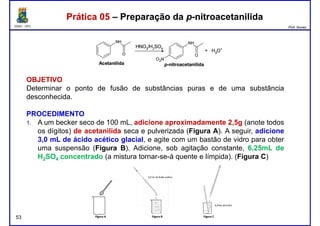
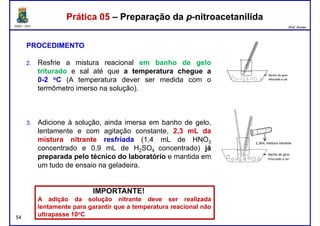
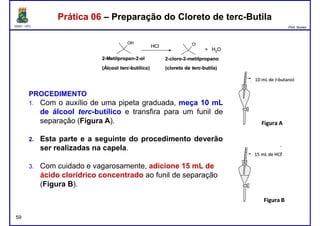
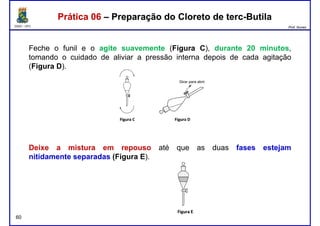
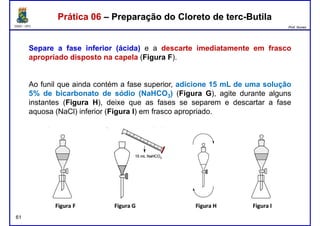
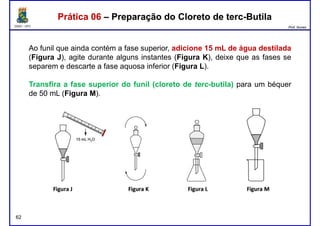
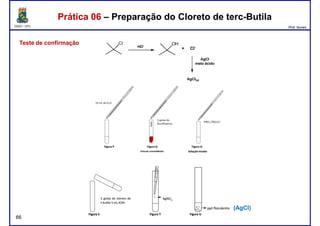
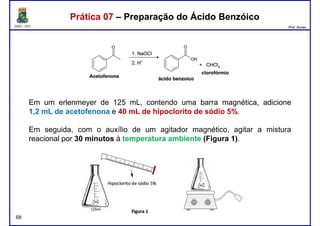
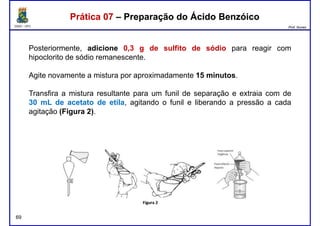
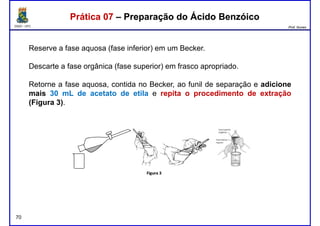
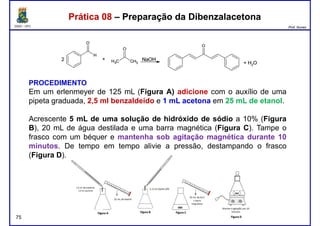
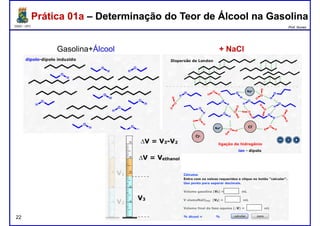
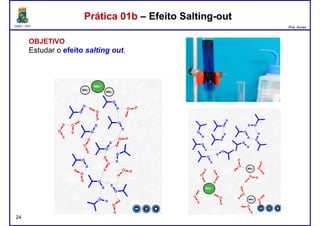
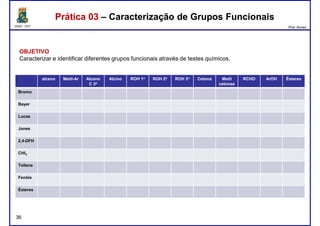
Este documento fornece informações sobre as aulas práticas de Química Orgânica Experimental no Departamento de Química Orgânica e Inorgânica da Universidade Federal do Ceará. Ele lista as datas das aulas práticas, os tópicos a serem discutidos e as práticas a serem realizadas, incluindo a determinação do teor de álcool na gasolina e o efeito salting-out na primeira aula prática em 5 de abril. O documento também fornece instruções detalhadas sobre biossegurança para as



























![DQOI - UFC Prof. Nunes
R
O
R
cetonas
+ 2 [Ag(NH3)2]OH
X
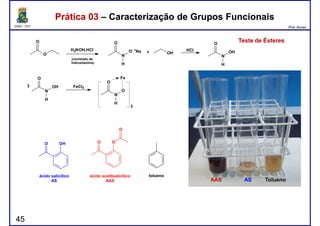
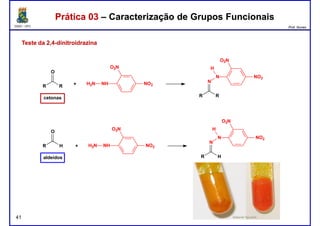
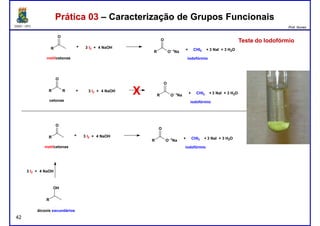
Prática 03 – Caracterização de Grupos FuncionaisPrática 03 – Caracterização de Grupos Funcionais
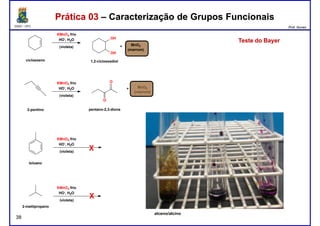
Teste deTeste de TollensTollens
espelho de prataespelho de prata
R
O
H
aldeídos
+ 2 [Ag(NH3)2]OH
R
O
O- + NH4 + Ago
+ 3 NH3 + H2O
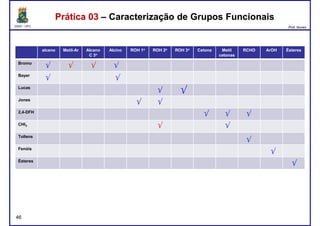
43
aldeído
cetona](https://image.slidesharecdn.com/teoriadasprticas873-170322133436/85/Teoria-das-praticas-CE0873-43-320.jpg)
![DQOI - UFC Prof. Nunes
OHO
+ [Fe(H2O)6]3+
Fe(H2O)3(OAr)3 + 3 H3O+
ácido salicílico
Prática 03 – Caracterização de Grupos FuncionaisPrática 03 – Caracterização de Grupos Funcionais
Teste de FenóisTeste de Fenóis
X
ácido salicílico
AS
OO
O
+ [Fe(H2O)6]3+
Fe(H2O)3(OAr)3 + 3 H3O+
ácido acetilsalicílico
AAS
44
AS AAS Tolueno
+ [Fe(H2O)6]3+
Fe(H2O)3(OAr)3 + 3 H3O+
tolueno
X](https://image.slidesharecdn.com/teoriadasprticas873-170322133436/85/Teoria-das-praticas-CE0873-44-320.jpg)