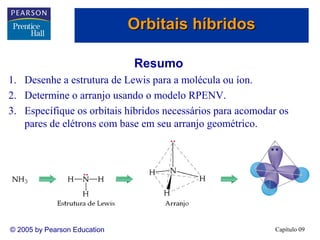
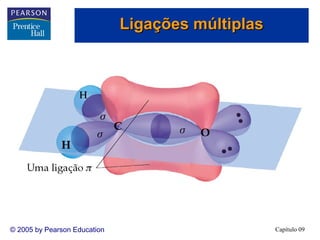
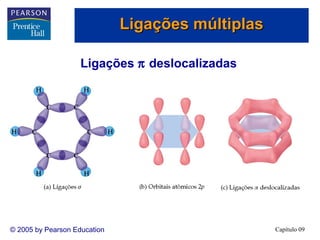
1. A hibridização sp3d é necessária para arranjos de bipirâmide trigonal, enquanto a hibridização sp3d2 é necessária para arranjos octaédricos.
2. O arranjo geométrico determina a hibridização necessária para acomodar os pares de elétrons.
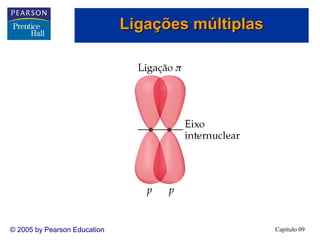
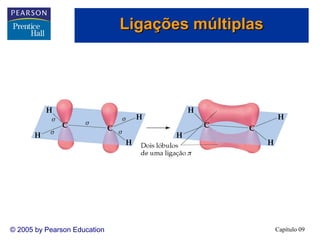
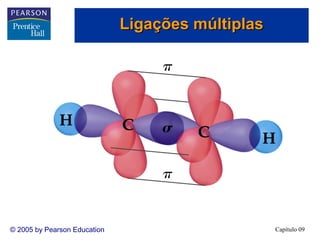
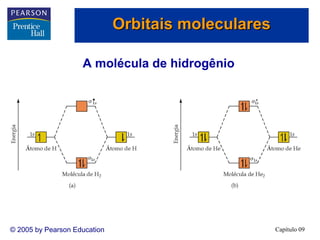
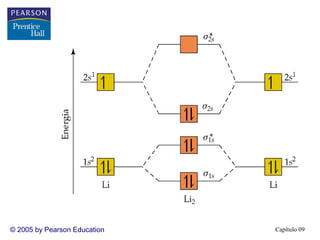
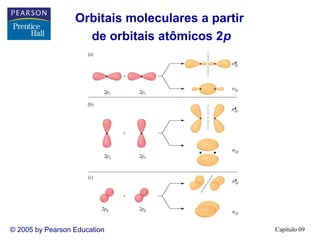
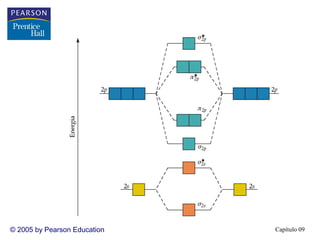
3. A teoria dos orbitais moleculares explica propriedades como a interação magnética do O2 que não são explicadas pela teoria de Lewis e hibridização.