Este documento apresenta um resumo do Capítulo 22 do livro "Química: A Ciência Central". O capítulo discute propriedades e reações químicas de não-metais, incluindo hidrogênio, gases nobres e halogênios. É apresentada uma discussão sobre tendências periódicas, preparação, utilização e compostos destes elementos.





























![Oxigênio
g
Propriedades do oxigênio
• O oxigênio tem dois alótropos: O2 e O3.
• O O2 é um gás incolor e inodoro na temperatura ambiente.
á i l i d t t bi t
• A configuração eletrônica é [He]2s22p4, o que significa que o
estado de oxidação dominante é -2.
2
• A ligação O=O é forte (entalpia de ligação 495 kJ/mol).
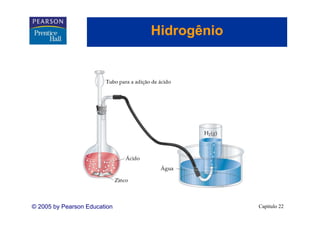
Preparação do oxigênio
• Comercialmente: obtido por destilação fracionária do ar. (o ponto
de ebulição normal do O2 é -183°C e do N2 é -196°C.)
© 2005 by Pearson Education Capítulo 22](https://image.slidesharecdn.com/22-quimicadosnaometaiscapitulo22-121213104310-phpapp01/85/22-quimica-dos-nao_metais_capitulo-22-31-320.jpg)













![Outros elementos do grupo
6A: S Se Te e Po
S, Se, Te,
Óxidos, oxiácidos e oxiânions de enxofre
Ó
• O Na2SO3 e o NaHSO3 são usados como preservantes.
• Quando o enxofre queima no ar, são formados tanto SO2 (produto
principal) quanto SO3.
• A oxidação do SO2 a SO3 necessita de um catalisador
(normalmente V2O5 ou Pt).
• O SO3 é usado para produzir H2SO4:
d d i
SO3(g) + H2SO4(l) → H2S2O7(l) [ácido polissulfúrico]
H2S2O7(l) + H2O(l) → 2H2SO4(l)
© 2005 by Pearson Education Capítulo 22](https://image.slidesharecdn.com/22-quimicadosnaometaiscapitulo22-121213104310-phpapp01/85/22-quimica-dos-nao_metais_capitulo-22-46-320.jpg)



![Nitrogênio
g
Propriedades do nitrogênio
p g
• Diversos estados de oxidação
comuns (de -3 a +5). Mais comum
+5, 0 e -3 (configuração eletrônica
[He]2s22p3).
© 2005 by Pearson Education Capítulo 22](https://image.slidesharecdn.com/22-quimicadosnaometaiscapitulo22-121213104310-phpapp01/85/22-quimica-dos-nao_metais_capitulo-22-50-320.jpg)














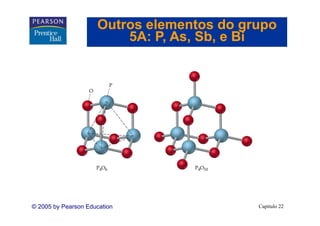














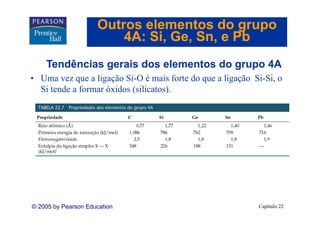




![Outros elementos do grupo
4A: Si Ge Sn, e Pb
Si, Ge, Sn
Silicatos
• Se dois SiO42- se ligam, um átomo de O
é compartilhado.
• Esta estrutura é o íon disilicato, Si2O76-.
• Para se determinar a carga no íon,
g ,
precisamos olhar os estados de oxidação
(+4 para o Si e -2 para o O): {[2×(+4)]
+[7×(-20]} = -6.
[7 ( 20]} 6
© 2005 by Pearson Education Capítulo 22](https://image.slidesharecdn.com/22-quimicadosnaometaiscapitulo22-121213104310-phpapp01/85/22-quimica-dos-nao_metais_capitulo-22-86-320.jpg)







