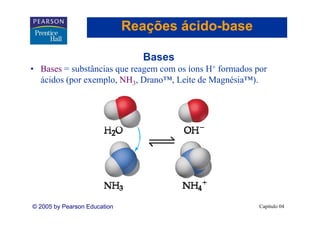
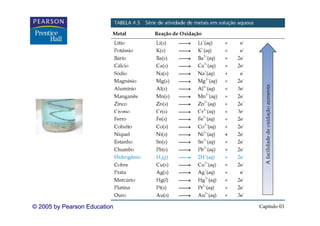
Este capítulo discute propriedades de soluções aquosas, incluindo:
1) Soluções podem conduzir eletricidade dependendo do número de íons;
2) Compostos iônicos se dissociam em íons em solução, enquanto compostos moleculares não;
3) Eletrólitos são classificados como fortes ou fracos.